بدن گیاهان و جانوران از میلیونها سلول مختلف تشکیل شده است که در اندامهای مختلفی کنار هم جمع میشوند. برای حفظ هومئوستازی بدن نیاز است که این سلولها با هم هماهنگ عمل کنند. تنظیم شیمیایی و عصبی دو مکانیسم مهم تنظیمی در مهرهداران است. غدد اندوکرین و هورمونهای آن در بدن انسان، نقش اصلی در تنظیم شیمیایی فرایندهای مختلف بدن دارد. در این مقاله غدد سیستم اندوکرین، هورمونها و مکانیسمهای تنظیمی آن را توضیح میدهیم.
تنظیم شیمیایی چیست ؟
تنظیم شیمیایی یکی از مکانیسمهای تنظیمی در بدن جانوران و گیاهان است که با استفاده از مولکولهای شیمیایی به نام هورمون فعالیت دستگاهها بدن را هماهنگ میکند. دستگاه تنظیم شیمیایی در جانوران از غدههای ترشحکننده هورمونها (غدد اندوکرین)، مولکول هورمون (پیک شیمیایی) و رسپتورهای بافت هدف (گیرنده پیک شیمیایی) تشکیل میشود. در ادامه این مطلب ساختار و عملکرد هر یک از این بخشها را با جزئیات بررسی میکنیم.
مسیرهای انتقال پیام شیمیایی در جانوران کدامند ؟
پیامرسانی پاراکرین، اندوکرین، اتوکرین و انتقال مستقیم (بین اتصالات شکافی) چهار مسیر انتقال پیام شیمیایی در جانوران هستند. فاصله بین سلول مبدا و هدف، تفاوت اصلی این مسیرهای انتقال پیام است.
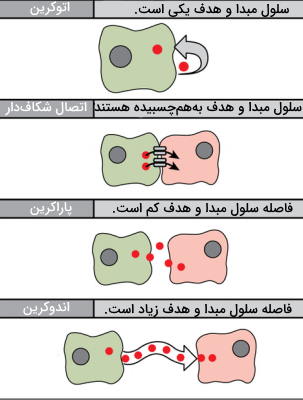
پیامرسانی اوتوکرین
در این نوع پیامرسانی سلول تولیدکننده و هدف پیک شیمیایی یکی است. این نوع پیامرسانی بیشتر در مراحل اولیه رشد و برای تنظیم مسیر تمایزی سلولها کاربرد دارد. از این مسیر پیامرسانی در تنظیم گیرندههای درد و پاسخهای التهابی استفاده میشود. به علاوه سلولهای آلوده به ویروس پیام فعالسازی آپوپتوز را بهوسیله این مسیر انتقال میدهند.
پیامرسانی پاراکرین
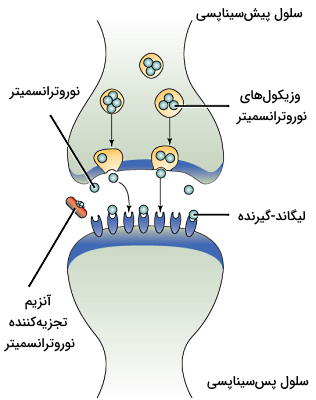
در این مسیر انتقالی فاصله بین سلول مبدا و هدف بسیار کم است و پیک شیمیایی برای انتقال به ماتریکس خارج سلولی منتشر میشود. سرعت انتقال پیام در این پیکهای شیمیایی زیاد است و پس از انتقال پیام بهوسیله آنزیمها تجزیه یا بهوسیله سلولهای اطراف جذب میشوند. انتقال نوروترانسمیترها در بافت عصبی یکی از مثالهای پیامرسانی پاراکرین است. در این بافتها پس از انتقال جریان عصبی به انتهای نورون پیشسیناپسی، نوروتراسمیترها وارد فضای سیناپسی شده و به گیرنده خود در سطح غشای نورون پس سیناپسی متصل میشوند. تغییر اختلاف پتانسیل الکتریکی در سلول پسسیناپسی، پیام عصبی را منتقل میکند.
پیامرسانی اندوکرین
این سیستم پیامرسانی برای انتقال پیام بین سلولهایی است که فاصله زیادی با هم دارند و هورمونها پیک شیمیایی این سیستم هستند. این مولکولها از انواع مختلفی تشکیل شدهاند که پس از تولید در سلول مبدا به خون ترشح میشوند و پس از اتصال به گیرنده سلول هدف بین دورترین سلولهای بدن ارتباط برقرار میکنند.
انتقال پیام از اتصالات شکافدار
اتصالات شکافدار غشای پلاسمایی دو سلول کنار هم در سلولهای جانوری و پلاسمودسماتای یاختههای گیاهی را به هم متصل میکنند. این اتصالات از کانالهای حاوی مولکول آب تشکیل شده است که مواد کوچک مثل کاتیونهای کلسیم را بین سیتوپلاسم دو سلول منتقل میکند. اننتقال پیام در این روش بسیار سریع انجام میشود انتقال یونهای کلسیم بین سلولهای ماهیچهای قلب با استفاده از این روش انجام میشود.
غدد درون ریز تنظیم شیمیایی
غدد درونریز مجموعهای از سلولهای هستند که ژن کدکننده هورمونهای مختلف در آنها بیان میشود. این پیکهای شیمیایی پس از تولید به جریان خون ترشح و بهوسیله جریان خون به اندامها منتقل میشوند. این غدد فعالیتهای مختلف بدن ازجمله متابولیسم، رشد استخوانها، تولید گلبولهای قرمز، افزایش یا کاهش دفع الکترولیتها و تولید مثل را تنظیم میکنند. هیپوفیز، غده پینهآل، تیروئید، غدد پاراتیروئید، بخش اندوکرین پانکراس و سلولهای اندوکرین دیواره لوله گوارش، غدد فوق کلیه و گونادها (تخمدان و بیضه) غدههای اندوکرین بدن انسان هستند که بهوسیله هیپوتالاموس کنترل میشوند. شبکه مویرگی گستردهای اطراف سلولهای این غدد را میپوشاند.

هورمون های سیستم تنظیم شیمیایی
هورمونها مولکولهای شیمیایی کوچکی هستند که پیامهای تنظیم شیمیایی بدن را از غده مبدا به بافت هدف منتقل میکنند. این پیکها از مولکولهای آمینی (مشتق از آمینواسید)، پپتیدی (پروتئینهای کوچک) یا استروئیدها (مشتق از کلسترول) ساخته میشوند که مسیر انتقال پیام در هر کدام متفاوت است.
- هورمونهای آمینی: این هورمونها از آمینواسیدهای تریپتوفان یا تیروزین مشتق میشوند. برای تولید این هورمونها گروه عاملی کربوکسیل در واکنشهای آنزیمی از زنجیره اصلی جدا میشوند. اما آمین زنجیره اصلی در محصول نهایی (هورمون آمینی) باقی میماند. ملاتونین یکی از هورمونهای آمینی مشتق از تریپتوفان است که در غده پنیهآل تولید و پس از ترشح در خون ریتم شبانهروزی بدن (ساعت زیستی بدن) را تنظیم میکند. هورمونهای تیروئیدی و کتکولآمینها (اپینفرین، نوراپینفرین و دوپامین) هورمونهای آمینی مشتق از تیروزین هستند. اپینفرین و نوراپینفرین هورمونهای واکنشهای حمله یا گریز هستند که از غدد فوق کلیه ترشح میشوند. اما دوپامین هورمون تنظیمی است که در سلولهای هیپوتالاموس تولید میشود و ترشح هورمونهای بخش جلویی هیپوفیز را تنظیم میکند.
- هورمونهای پپتیدی: این هورمونها برخلاف هورمونهای آمینی از کنار هم قرار گرفتن بیش از ۲ آمینواسید تشکیل میشوند. سنتز این هورمونها مثل سایر پروتئینهای بدن به رونویسی و ترجمه ژنها وابسته است.
- هورمونهای استروئیدی: این هورمونها تعداد کمی از پیکهای شیمیایی بدن را تشکیل میدهند. گونادوهورمونها (هورمونهای جنسی)، آلدوسترون و کورتیزول هورمونهای استروئیدی هستند که بهوسیله غدد جنسی و فوق کلیه ترشح میشوند. این هورمونهای آبگریز برای انتقال در خون با پروتئینها جفت میشوند. به همین دلیل نیمهعمر (مدت زمان لازم برای تجزیه نصف ) آنها در بدن بیشتر از دو گروه هورمونی دیگر است. برای مثال نیمهعمر هورمون کورتیزول ۶۰ تا ۹۰ دقیقه اما نیمهعمر هورمون اپینفرین تنها ۱ دقیقه است.
پیام هورمون ها چگونه منتقل می شود ؟
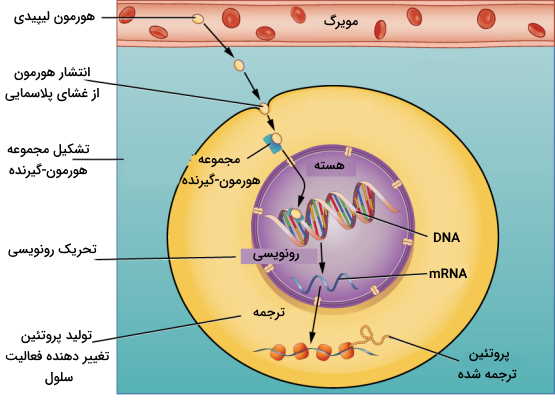
در تنظیم شیمیایی اندوکرین، انتقال پیام هورمون وابسته به گیرنده است. گیرنده هورمونها بر اساس ساختار شیمیایی و نوع هورمونها، گلیکوپروتئینی عرض غشایی در غشای پلاسمایی سلول هدف یا پروتئینی درون سیتوپلاسمی یا غشای هستهای است. هورمونهای پپتیدی مولکولهای بزرگی هستند که نمیتوانند بهوسیله انتشار ساده از غشای سلول عبور کنند. به همین دلیل گیرنده این پیکهای شیمیایی در غشای پلاسمایی سلول هدف قرار دارد. هورمونهای آمینی مولکولهای آبدوستی هستند که در غشای آبگریز حل نمیشوند و به همین دلیل گیرنده آنها نیز گلیکوپروتئین عرض غشای سیتوپلاسمی است. اما هورمونها هیدروفوب و کوچک استروئیدی بهوسیله انتشار ساده از غشای سلول عبور میکنند و گیرنده آنها در سیتوپلاسم یا غشای هسته قرار دارد.
گیرنده های درون سلولی
هورمون تیروئیدی تنهال هورمون آمینی است که به دلیل ویژگی آبگریزی حلقه بنزنی زنجیره جانبی از غشای پلاسمایی عبور میکند و گیرنده آن در سطح غشای هسته قرار دارد. هورمونهای استروئیدی پس از عبور از غشا به گیرندههای سیتوپلاسمی متصل میشوند و مجموعه گیرنده-هورمون پس از ورود به هسته به قسمتهای تنظیمی DNA متصل خواهد شد.
گیرنده این هورمونها فاکتورهای تنظیم رونویسی هستند که در نبود هورمونها به «پروتئین شوک گرمایی» (Heat Shock Protein | HSP) متصل میشوند. اتصال هورمون-گیرنده جدا شدن HSP و اتصال پروتئین تنظیمی به «توالی پاسخدهنده هورمون» (Hormone Responding Element | HRE) در ژن را به دنبال دارد. بر اساس نوع هورمون مسیرهای متابولیکی و آنابولیکی مختلفی در سلول فعال میشود.
گیرنده های غشایی
گیرنده تمام هورمونهای پپتیدی و آمینی (به جز هورمونهای تیروئیدی) در سطح غشای سلول هدف قرار دارد و پیام تحریک یا مهار رونویسی ژن را با واسطه مولکولهای داخل سیتوپلاسم منتقل میکند. گیرنده این پیکهای شیمیایی از سه بخش مختلف (خارج غشایی، بین اسیدهای چرب فسفولیپید و سیتوپلاسمی) تشکیل میشود. جایگاه اختصاصی اتصال هورمون در بخش خارج غشایی قرار دارد. بخش درون غشایی از توالی آمینواسیدهای هیدروفوبی تشکیل میشود که بین دو بخش دیگر ارتباط برقرار و ۷ بار از عرض غشا عبور میکنند. بخش درون غشای در گیرندههای مختلف متفاوت و با مولکولهای شروع واکنشهای آبشاری داخل سلول در ارتباط است. واکنشهای آبشاری، واکنشهای متوالی هستند که در نهایت همانندسازی DNA، رونویسی ژن، باز شدن کانالهای یونی (تغییر نفوذپذیری غشا) یا فعال شدن آنزیمهای مسیرهای متابولیکی را تحریک میکنند.
از آنجا که این هورمونها وارد سلول نمیشوند نیاز به مولکول واسطهای دارند که وظیفه انتقال پیام در سیتوپلاسم را بر عهده بگیرد. این مولکول واسطه پیک یا «پیامرسان ثانویه» (Second Messenger) نام دارد. آدنوزین مونوفسفات حلقوی (cAMP)، دیآسیل گلیسرول (DAG) و اینوزیتول تریفسفات (IP۳) سه پیامرسان ثانویه اصلی در سلولهای جانوری هستند که با فعال کردن واکنشهای آبشاری مختلف بیان ژنها را تغییر میدهند.
انواع G پروتئین
G پروتئینها آنزیمهای GTPآزی هستند که در سه نوع
، و در مسیرهای انتقال پیام هورمونهای پپتیدی شرکت میکنند. کنفورماسیون غیرفعال این پروتئینها به GDP و کنفورماسیون فعال آنها به GTP متصل است. آنزیم آدنیلاز سیکلاز، آنزیم فسفولیپاز C را فعال و
آنزیم این دو آنزیم را غیر فعال میکند.
انتقال پیام با cAMP
cAMP پیامرسان ثانویه بسیاری از هورمونهای محلول در آب است. این مسیر در شش مرحله پیام هورمون را به سلول منتقل میکند. در مرحله اول هورمون به بخش خارج غشایی گیرنده متصل می شود. اتصال هورمون گیرنده تغییر کنفورماسیون ساختار گیرنده و فعال شدن G پروتئین متصل به بخش سیتوپلاسمی را به دنبال دارد. G پروتئینها آنزیم آدنیلازسیکلاز را فعال (یا مهار) میکنند. آدنیلازسیکلاز با جدا کردن یک فسفات از GTP و غیرفعال کردن G پروتئین، تبدیل ATP به cAMP را کاتالیز میکند. cAMP مولکول فعالکننده گروهی از آنزیمهای سیتوپلاسمی به نام پروتئین کینازهای A است. کینازهای A پروتئینهای تنظیمی و آنزیمهای درون سلولی زیادی را با استفاده از فسفات ATP فسفوریله میکنند. کلسیتونین (هورمون تنظیم غلظت کلسیم خون و رشد استخوان)، گلوکاگون (هورمون تنظیمکننده گلوکز خون) و هورمون محرک تیروئید (هورمون تنظیم ترشح T۳ و T۴) از این مسیر انتقال پیام استفاده میکنند.
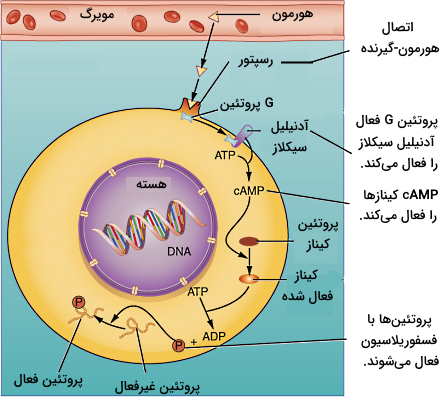
وجود پیک ثانویه و فسفوریلاسیونهای متوالی سبب میشود پیام سریع و با غلظت کم هورمون در خون منتقل شود. اما اثر هورمون مدت زمان کوتاهی در سلول باقی میماند. چراکه آنزیم فسفودیاستراز سیتوپلاسمی با غیرفعال کردن cAMP اولین حلقه زنجیره واکنشها را از بین میبرد و سلول آماده دریافت مولکول هورمون بعدی خواهد شد.
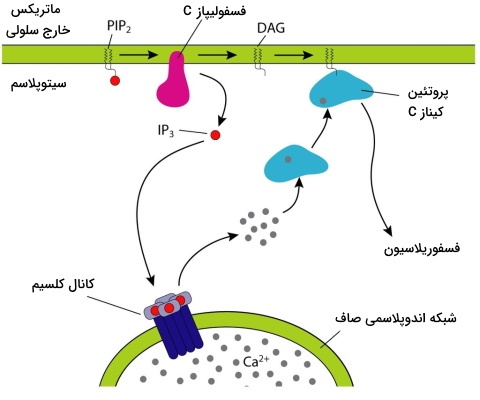
انتقال پیام با DAG و IP۳
در این مسیر انتقال بخش سیتوپلاسمی گیرنده هورمون با G پروتئینی (
) در ارتباط است که آنزیم فسفولیپاز C را فعال میکند. این آنزیم فسفولیپیدهای غشای سلولی را به دیآسیل گلیسرول (DAG) و اینوزیتول تریفسفات (IP۳) میشکند. DAG با فعال کردن پروتئین کیناز C سیتوپلاسم، آبشاری از واکنشهای فسفوریلاسیون همزمان در سلول را فعال میکند. اتصال IP۳ به گیرندههای سطح شبکه اندوپلاسمی صاف سبب باز شدن کانالهای کلسیمی و رهایش یون کلسیم از این اندامک به سیتوپلاسم میشود. در مرحله بعد کلسیم آزاد شده از دو مسیر مستقیم و غیر مستقیم واکنشهای آنزیمی سلول را فعال میکند. فسفودیاستراز آنزیمی است که با مهار فسفولیپاز C پاسخ به هورمون را در این مسیر مهار میکند. هورمونهای آنژیوتانسین II و هورمون آزادکننده هورمون رشد (GHRH) ازجمله هورمونهایی هستند که با این مسیر در متابولسیم و عملکرد سلول تغییر ایجاد میکنند.
- مسیر مستقیم کلسیم: با اتصال به آنزیمها فعالیتهای سلولی را تغییر میدهد.
- مسیر غیر مستقیم کلسیم: به پروتئینهای اتصال کلسیم ازجمله کلمودولین وصل میشود و فعالیت سلول را تغییر میدهد. کلمودولین با اتصال با کینازهای سیتوپلاسمی آبشاری از واکنشهای فسفوریلاسیون در سلول را شروع میکند. پروتئینهای فسفوریله شدن در این مسیر انقباض ماهیچه، رونویسی ژنها یا مسیرهای متابولیکی را تحریک میکنند.
مکانیسم های تنظیمی هورمون
اثر هورمون بر سلول هدف و ترشح هورمون از سلول مبدا با مکانیسمهای متفاوتی تنظیم میشوند. کاهش و افزایش تعداد گیرنده ها در سلول هدف (به خصوص گیرندههای غشایی) اثر هورمون در این سلولها را تغییر میدهد. زمانی که غلظت هورمون در خون زیاد است، تعداد گیرندههای در دسترس هورمون با ورود به سلول کاهش مییابد (مکانیسم تنظیم کاهشی | Downregulation). با کاهش غلظت خونی هورمون تعداد گیرندههای غشا و حساسیت سلول هدف به هورمون افزایش مییابد (مکانیسم تنظیم افزایشی | Upregulation).
علاوه بر مکانیسمهای تنظیمی افزایش و کاهشی، سه برهمکنش بین هورمونها اثر سلولی این مولکولهای شیمیایی را تغییر میدهد.
- «اثر فعالکننده» (Permissive Effect): در این برهمکنش ترشح یک هورمون سبب فعالیت هورمون دیگر میشود. ارتباط هورمونهای تیروئیدی با هورمونهای سیستم تولید مثلی از این نوع است.
- «اثر همافزایی» (Synergistic Effect): در این برهمکنش دو هورمون کتفاوت اثر یکسانی دارند و پاسخ سلولی را افزایش میدهند و در بعضی موارد ترشح دو هورمون برای ایجاد پاسخ مناسب الزامی است. برای مثال FSH (هورمون هیپوفیز) و استروژن (هورمون تخمدان) برای بلوغ تخمک در زنان الزامی است.
- «اثر آنتاگونیست» (Antagonistic Effect): در این برهمکنش اثر دو هورمون مخالف هم است. عملکرد دو هورمون تنظیمکننده قند خون که از سلولهای اندوکرین پانکراس ترشح میشوند بهترین مثال برای ایتن برهم کنش است. انسولین قند خون را کاهش و جذب گلوکز از سلولهای کبدی برای تشکیل گلیکوژن را افزایش میدهد. اما گلوکاگون تجزیه پلیمرهای گلیکوژن و قند خون را افزایش میدهد.
ترشح هورمون از سلول مبدا بهوسیله دو مکانیسم «بازخورد مثبت» (Positive Feedback) و «بازخورد منفی» (Negative Feedback) تنظیم میشود. در بازخورد مثبت افزایش غلظت یک هورمون در خون، تولید و ترشح آن هورمون را افزایش میدهد. در مکانیسم خودتنظیمی منفی افزایش غلظت یک هورمون در خون، تولید و ترشح آن را کاهش میدهد. برای مثال ترشح اوکسیتوسین در فرایند تولد نوزاد بهوسیله مکانیسم خود تنظیمی مثبت کنترل میشود. در تولد نوزاد اتصال اوکسیتوسین به گیرندههای سلول ماهیچههای صاف رحم، سبب انقباض ماهیچه و حرکت سمت لگن جنین میشود. این حرکت کشش دیواره رحم را به همراه دارد. پیام عصبی حاصل از تحریک گیرندههای کششی دیواره به هیپوفیز ترشح اوکسیتوسین بیشتر و افزایش شدن انقباضهای رحم را تحریک میکند. ترشح این هورمون پس از تولد نوزاد کاهش مییابد.
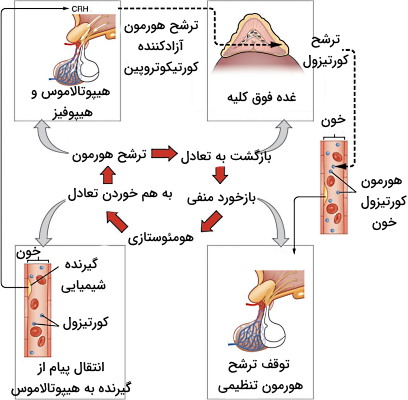
ترشح بیشتر هورمونهای سییستم اندوکرین بهوسیله مکانیسم خودتنظیمی منفی کنترل میشود. برای مثال افزایش هورمون کورتیزول در خون منجر به کاهش تولید و ترشح هورمونهای تحریکی هیپوتالاموس و هیپوفیز را مهار میکند. در نتیجه هورمون کورتیزول کمتری به خون ترشح میشود.
انواع غدد درونریز در تنظیم شیمیایی
در بخشهای قبلی توضیح دادیم که غدد درونریز یکی از اجزای اصلی تنظیم شیمیایی بدن است و انواع مختلف آن با هماهنگی بدن را در شرایط پایدار نگه میدارند. هیپوتالاموس، هیپوفیز، پینهآل، تیروئید، پاراتیروئید، پانکراس، غدد فوق کلیه، تخمدان و بیضه غدد اندوکرینی هستند که در تنظیم شیمیایی شرکت میکنند. هیپوتالاموس مرکز کنترل اصلی این غدد است.
غده هیپوتالاموس
هیپوتالاموس غدهای به اندازه یک بادام در سیستم لیمبیک مغز و مرکز کنترل غدد اندوکرین بدن است. این غده از چهار بخش جلویی ، پشتی، پایینی و بالایی تشکیل میشود که نوع سلولها و عملکرد آنها با هم متفاوت است. اثر نوروهورمونهای ترشح شده از این بخش مغز بر بخش پشتی (هیپوفیز عصبی) و جلویی هیپوفیز (هیپوفیز اندوکرین) ترشح هورمون از سایر غدد بدن را تحریک یا مهار میکند. هیپوتالاموس وظیفه تولید و ترشح هفت هورمون پپتیدی را بر عهده دارد.
- هورمون آزادکننده گونادوتروپین (GnRH): این هورمون با تحریک تولید و ترشح هورمونهای تحریک فولیکول (FSH) و هورمون چرخه لوتئال (LH) فعالیت گونادها را تنظیم میکند.
- هورمون آزادکننده (GHRH) یا مهار کننده (GHIH) هورمون رشد: GHRH ترشح هورمون رشد را تحریک و GHIH ترشح این هورمون را مهار میکند. کارایی این هورمون در رشد کودکان اهمیت بسیاری دارد. این هورمون در بزرگسالی تقویت استخوانها، بافت ماهیچهای و پراکندگی بافت چربی را تنظیم میکند.
- هورمون مهار (PIH) یا تحریک (PRH) ترشح پرولاکتین: ترشح این هورمون تولید زیر در غدد پستان را افزایش (PRH) یا کاهش (PIH) میدهد. تولید این هورمون در مردان یکی از علائم پاتولوژیک بدن است.
- هورمون آزادکننده تیروتروپین (TRH): این هورمون با افزایش تولید هورمون تحریک تیروئید، متابولیسم بدن را تنظیم میکند.
- هورمون ضد ادراری (ADH): این هورمون بازجذب آب در کلیه را افزایش میدهد.
- هورمون آزادکننده کورتیکوتروپین (CRH): این هورمون با تحریک تولید و ترشح هورمونهای استروئیدی از غده فوق کلیه (کورتیکواستروئید) در تنظیم متابولیسم و سیستم ایمنی بدن نقش دارد
تنظیم شیمیایی بدن با هورمون ضد ادراری
افزایش اسمولایتی (کاهش آب و افزایش الکترولیتها) خون با تحریک اسمورسپتورهای هیپوتالاموس و کاهش فشار خون با ترشح آنژیوتانسین II از سلولها و اتصال آن به گیرندههای هیپوتالاموس سنتز ADH و انتقال آن به هیپوفیز را تحریک میکند. گیرنده ADH در غشای سیتوپلاسمی سلولهای اصلی کلیه در دیواره لوله جمعکننده ادرار و ماهیچههای صاف مویرگها قرار دارد. اتصال این هورمون به گیرنده در سلولهای اصلی کلیه (وازوپرسین II) از مسیر cAMP و فعال کردن پروتئین کیناز A سنتز آکوپروین II (کانالهای انتقال آب در لوله جمعکننده ادرار) را تحریک میکند. این پروتئینها در غشای وزیکولهای خروجی از دستگاه گلژی و پس از آن در غشای سلولهای اصلی قرار میگیرند. در نتیجه بازجذب آب از لوله جمعکننده ادرار به خون افزایش مییابد و اسمولالیتی خون به حالت طبیعی (ایزوتونیک) برمیگردد.
اتصال این هورمون به گیرندههای سطح غشای پلاسمایی در ماهیچه صاف مویرگ (وازوپرسین I) از مسیر IP۳ غلظت یون کلسیم و انقباض ماهیچهها را افزایش میدهد (وازوکانستریکشن | Vasoconstriction). انقباض ماهیچهها منجر به کاهش قطر رگ و افزایش مقاومت به جریان خون میشود. در نتیجه فشار خون افزایش مییابد.
آسیب هیپوتالاموس و کاهش ترشح آنتیدیورتیک هورمون منجر به بیماری «دیابت بیمزه» (Diabetes Insipidus) میشود. تشنگی و تکرر ادرار از علائم این بیماری است. افزایش ترشح ADH (تومورهای هیپوتالاموس یا برخی انواع مننژیت) با افزایش بازجذب آب در خون و ایجاد ادم در بافتهای مختلف ازجمله مغز میشود.
هیپوفیز
هیپوفیز دومین غده مهم در سیستم عصبی مرکزی است که در تنظیم سیستم اندورین پستانداران نقش دارد. محل این هورمون در مغز پایینتر از هیپوتالاموس و به اندازه یک نخود سبز است. بخش عصبی (پشتی) این غده بهوسیله نورونها و بخش اندوکرین آن (جلویی) بهوسیله شبکه مویرگی گسترده با هیپوتالاموس در ارتباط است. لوب اندوکرین این غده بیشتر حجم (حدود ۷۵٪) این بخش مغز را به خود اختصاص میدهد و هورمونهای بیشتری تولید میکند. بخش عصبی این غده ADH و اکسیتوسین تولید شده در هیپوتالاموس را ذخیره و به خون ترشح میکند. لوب اندوکرین هیپوفیز وظیفه تولید ۷ هورمون سیستم اندوکرین را بر عهده دارد.
- هورمون رشد انسان (hGH): این هورمون رشد بافتها و سنتز پروتئین برای ترمیمی بافت را تحریک میکند.
- هورمون تحریک تیروئید (TSH): این هورمون تولید هورمونهای T۳ و T۴ تیروئید را تحریک می کند.
- هورمون تحریک فولیکول (FSH): این هورمون تولید و ترشح استروژن، همچنین رشد و بلوغ تخمک در زنان را تحریک میکند. به علاوه تحریک تولید اسپرم (اسپرماتوژنز) در بیضه مردان بر عهده این هورمون است.
- هورمون چرخه لوتئال (LH): این هورمون ترشح استروژن، پروژسترون (زنان) و تستسترون (مردان) از غدد جنسی را تحریک میکند.
- پرولاکتین (PRL): این هورمون تولید و ترشح شیر از غدد برون ریز پستان را تحریک میکند.
- هورمونهای تحریک غدد فوق کلیه (ACTH): این هورمون با تحریک ترشح کورتیزول از سلولهای قشر غدد فوق کلیه در واکنش به استرسهای محیطی نقش دارد.
- هورمون تحریک ملانوسیت (MSH): سلولهای ملانوسیت کارخانه تولید رنگدانههای ملانین هستند. این هورمون با تحریک ملانوسیتها در تیره شدن پوست نقش دارد.
هورمون رشد
تولید و ترشح هورمون آزاد کننده هورمون رشد (GHRH) از «هسته آرکیوئت» (Arcuate Nucleus) هیپوتالاموس، محرک اصلی سنتز و ترشح هورمون رشد (GH) در سلولهای سوماتوتروپ بخش جلویی غده هیپوفیز است. افزایش غلظت آمینواسیدها در خون، کاهش گلوکز خون، کاهش اسید چرب خون، انجام تمرینات ورزشی و استرسهای فیزیولوژیک ترشح GHRH از هیپوتالاموس را تحریک میکنند. اتصال این هورمون پپتیدی به گیرندههای سطح آدیپوسیتها با فعال کردن لیپاز حساس به هورمون تجزیه تریگلیسیریدها به گلیسرول و اسید چرب را تحریک میکند. ترکیبات حاصل از این فرایند در مسیر متابولیکی گلوکونئوژنز به گلوکز تبدیل میشوند. در نتیجه هورمون رشد غلظت گلوکز در خون را افزایش میدهد. اثر این هورمون بر سلولهای ماهیچهای مثل اثر IGF-۱ است. اتصال GH به گیرنده سطح هپاتوسیتها (سلولهای کبدی) از مسیر JAK-STAT رونویسی و بیان ژنهای مسیر گلیکونئوژنز و فاکتور رشد شبه انسولینی ۱ (IGF-۱) میشود. IGF-۱ پس از اگزوسیتوز از سلولهای کبدی به گیرنده سطح سلولهای ماهیچهای، متصل میشود.
- اتصال هورمون-گیرنده در سلولهای ماهیچه اسکلتی با فعال کردن کانالهای آمینواسیدی از مسیر IP۳ ، ورود آمینواسید به سیتوپلاسم سلول و پروتئینسازی ماهیچه اسکلتی (اکتین، میوزین و فیبرین) و در نتیجه حجم ماهیچه را افزایش میدهد.
- اتصال هورمون-گیرنده در استخوان با افزایش فعالیت استئوکلاستها و استئوبلاستها، «تشکیل استخوان» (Endochondral Ossification) و در نتیجه طول استخوانها را افزایش میدهد. به علاوه این اتصال با افزایش سنتز کلاژن I و پروتئوگلایکانها ترکیب ماتریکس استخوانی را تنظیم میکند. به علاوه این هورمون مثل هورمونهای تیروئیدی بر صفحه اپیفیزی استخوان اثر دارند و طول استخوان را با افزایش تقسیم، اندازه و تمایز سلولهای غضروف هیالورونان، افزایش میدهند.
پینهآل
پینهآل یا اپیفیز سومین غده مغز است که از سلولهای اندوکرین تشکیل میشود. این غده به بخش بالایی (سقف) بطن سوم متصل است. بافت پارانشیم این غده با مویرگهای فراوانی رشتههای عصبی سمپاتیک تغذیه میشود. ملاتونین تنها هورمونی است که این غده برای تنظیم ترشح هورمونهای تولید مثلی و چرخه خواب-بیداری ترشح میکند. پینهآلوسیتها، نورونهای تمایزیافته این غده هستند که ملاتونین از زوائد جسم سلولی آنها خارج میشود.
- تنظیم هورمونهای تولیدمثلی: این هورمون ترشح FSH و FSH را مهار میکند.
- تنظیم چرخه خواب: سلولهای گیرنده نوری چشم (رتینا) شدت نور محیط را شناسایی میکند و پیام عصبی حاصل از آن را به هیپوتالاموس انتقال میدهند. انتقال پیام هیپوتالاموس به پینهآل، ترشح ملاتونین را تحریک میکند. شدت نور میزان ترشح ملاتونین را تغییر میدهد. هر چه شدت نور بیشتر باشد، ترشح ملاتونین کمتر است.
تیروئید
تیروئید یکی از غدد تنظیم شیمیایی بدن در گلو و زیر حنجرهای است که ساختاری شبیه به پروانه دارد. فولیکولهای (مجموعهای سلولهای اپیتلیال مکعبی) این غده واحدهای ساختاری و عملکردی هستند که سنتز و ترشح هورمونهای تیروئیدی را بر عهده دارند.
سنتز هورمون های تیروئید
اتصال هورمون آزادکننده تیروئید (TRH | هورمون هسته پاراونتیکولار هیپوتالاموس) به گیرندههای سلولهای بخش جلویی هیپوفیز (تیروتروپ)، ترشح هورمون تحریک تیروئید (TSH) از این غده را تحریک میکند. اتصال این هورمون به گیرندههای سطح سلولی فولیکولهای تیروئید از مسیر cAMP و پروتئین کیناز A، رونویسی و بین ژنهای پروتئین تایروگلوبولین را تحریک میکند. تایروگوبولین پس از بستهبندی وزیکولی در دستگاه گلژی بهوسیله اگزوسیتوز وارد لومن فولیکول میشود.
آمینواسیدهای تیروزین بخش اصلی زیرواحدهای تایروگلوبین را تشکیل میدهند. تبدیل این پروتئین به هورمون فعال به حضور ید نیاز دارد. ید لازم برای انجام این واکنش بهوسیله انتقال فعال ثانویه و سیمپورتر سدیم-ید از خون (یون ید) وارد سیتوپلاسم سلولهای فولیکولی میشود. «پندرین» (Pendrin) پروتئین غشای لومنی سلولهای فولیکول است که ید را به لومن فولیکول پمپ میکند. آنزیم تیروئید پروکسیداز آنزیمی است که با اکسایش یون ید (
) و اضافه کردن مولکولهای یدید به زنجیره جانبی تیروزینها (آیودینیشن | Iodination) در تشکیل هورمونهای تیروئیدی شرکت میکند. در پایان فعالیت این آنزیم، تایروگلوبین ترکیبی از هورمونهای T۴ و T۳ (دی تیروزینهایی که به ۳ و ۴ مولکول ید متصل هستند) و توالی آمینواسیدی جانبی است.
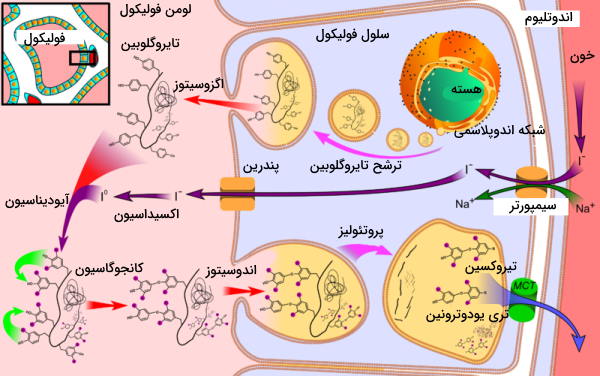
در مرحله بعد تایروگلوبین یددار بهوسیله اندوسیتوز وارد سلولهای فولیکولی میشود. پپتیدازهای لیزوزومی T۴ و T۳ را از سایر بخشهای پروتئین جدا میکنند و هورمونها بهوسیله اگزوسیتوز از سلول خارج میشوند. این هورمون به دلیل گروه عاملی فنول در زنجیره جانبی تیروزین انحلالپذیری کمی در خون دارد و بهوسیله گلوبینهای اتصالی به تیروکسین (سنتز شده در کبد) در خون حمل میشوند. غلظت تیروکسین (T۴) در خون از ترییدوتیرونین (T۳) بیشتر است.
سنتز کلسی تونین
«سلولهای پارافولیکول» (Parafollicular Cells) یا سلولهای C سلولهای اندوکرینی هستند که بین فولیکولهای غده تیروئید قرار دارند. ژن سنتز کلسیتونین (یکی از هورمونهای تنظیم کلسیم خون) در هسته این سلولها قرار دارد. افزایش کلسیم خون ترشح کلسیتونین در این سلولها را تحریک میکند. پس از رونویسی، ترجمه و تغییرات پس از ترجمه، دشتگاه گلژی این هورمون در وزیکولهای ذخیرهای بستهبندی میکند. به همین دلیل پارافولیکول گروهی از سلولهای اندوکرین بدن هستند که وزیکولهای فراوانی در سیتوپلاسم آنها وجود دارد. هایپرکلسمیا منجر به اگزوسیتوز این وزیکولها و ورود کلسیتونین (آنتاگونیست هورمون پاراتیروئیدی) به خون میشود.
گیرنده این هورمون در سطح سلولها استخوانی قرار دارد. اتصال این هورمون به گیرندههای استئوکلاستها، ترشح آنزیمهای تجزیهکننده استخوان را مهار میکنند. در نتیجه کلسیم و فسفات بیشتری بهوسیله استئوبلاستها در ماتریکس بافت استخوان ذخیره میشود.
نقش هورمون های تیروئیدی در تنظیم شیمیایی
گیرنده هورمونهای تیروئید تقریبا در سیتوپلاسم تمام سلولهای هستهدار بدن وجود دارد و اثر آن بر کبد، ماهیچه قلب، آدیپوسیتها، استخوان و سیستم عصبی مرکزی بسیاری از عملکردهای بدن را تغییر میدهد. مکانیسم عمل تیروکسین در سلولها مشابه است اما اثرات متفاوتی دارد. تیروکسین با انتشار ساده وارد سیتوپلاسم سلول میشود. آنزیم
دی آیودیناز، ید متصل به کربن
در تیروکسین را جدا میکند. در نتیجه فعالیت این آنزیم مولکول T۳ (شکل فعال هورمون تیروئید) در سلول تشکیل میشود. گیرنده سیتوپلاسمی این هورمون، فاکتور رونویسی است که از یک دومین اتصالی به مولکولهای شیمیایی (T۳ و رتینوئیک اسید) و یک دومین اتصالی به DNA تشکیل شده است. فاکتور رونویسی فعال شده، رونویسی و بیان ژنهای پمپ سدیم-پتاسیم غشا را تحریک میکند. در نتیجه متابولیسم سلول برای تولید ATP مورد نیاز فعالیت این پمپها افزایش مییابد. برای افزایش سنتز ATP سلول نیاز به میتوکندریهای بیشتر دارد. در نتیجه تقسیم میتوکندری در این سلولها افزایش مییابد. به علاوه افزایش متابولیسم، دمای بدن را افزایش میدهد.
- اثر هورمون تیروئیدی در سلولهای کبدی، گیکوژنولیز و در نتیجه گلوکز خون را افزایش میدهد. فعال کردن مسیر گلوکونئوژنز یکی دیگر از مکانیسمهای هورمون تیروئیدی برای افزایش گلوکز خون در سلولهای کبدی است. به علاوه این هورمون ها تعداد گیرندههای غشای کبد برای لیپوپروتئینهای کمچگال (LDL) را افزایش میدهند.
- اثر هورمون تیروئیدی در سلولهای میوکارد و گروه سینوسی-دهلیزی قلب، حساسیت غشای این سلولها (تعداد گیرندهها) به اپینفرین و نوراپینفرین را افزایش میدهند. در نتیجه انقباض و برونده قلب افزایش مییابد.
- اثر هورمون تیروئیدی در نورونهای سیستم عصبی مرکزی، تعداد دندریتها، تشکیل میلین و سیناپسها را افزایش میدهد. به همین دلیل اضطراب و پرخاش یکی از علائم پرکاری غده تیروئید است.
- اثر هورمون تیروئیدی در استخوانها فعالیت استئوبلاستها (سلولهای استخوانساز) و استئوکلاستها (سلولهای استخوانخوار) را تنظیم میکند. اثر هورمون تیروئید بر صفحه رشد یا صفحه اپیفیز (غضروف هیالوران دو انتهای استخوان) سبب افزایش طول استخوان میشود.
- اثر هورمون تیروئیدی در آدیپوسیتها لیپولیز تریگلیسیردهای ذخیره شده را بهوسیله فعال کردن لیپازها افزایش میدهد. گلیسرول و اسیدهای چرب زوج کربن حاصل از این فرایند وارد چرخه گلوکونئوژنز در کبد میشود.
- اثر هورمون تیروئیدی در سلولهای ماهیچه اسکلتی تعادل کاتابولیسم (تجزیه پروتئین به آمینواسید) و آنابولیسم پروتئینها (سنتز پروتئین از آمینواسید) را تنظیم میکند. پرکاری تیروئید این تعادل را با افزایش کاتابولیسم سلول تغییر میدهد. به همین دلیل ماهیچه افراد مبتلا به این اختلال ضعیفتر است. به علاوه این هورمون با کنترل کانالهای کلسیمی شبکه سارکوپلاسمی، انقباض ماهیچه را کنترل میکند.
- اثر هورمون تیروئیدی در سلولهای پوست ترشحات غدد اگزوکرین عرق را افزایش میدهد. به علاوه افزایش دمای بدن سبب افزایش جریان خون در مویرگهای پوستی و قرمز دیده شدن پوست خواهد شد.
- اثر هورمون تیروئیدی در سلولهای دیواره لوله گوارش ترشح مواد از سلولهای دیواره را تحریک میکند. این اثر انقباض ماهیچههای صاف دیواره و حرکات دیواره گوارش را افزایش میدهد.
غدد پاراتیروئید
چهار غده کوچک، بیضی و صاف در بخش پشتی چهار لوب تیروئیدی قرار دارند. سرخرگهای این غده از سرخرگ پایینی تیروئید منشعب میشود و عصب واگ (پاراسمپاتیک) وظیفه انتقال پیامهای عصبی به این بخش از سیستم تنظیم شیمیایی بدن را بر عهده دارد. بافت این غده از دو نوع سلول متفاوت (اوکسیفیل | Oxiphil و اصلی | Chief) تشکیل شده است. سلولهای اصلی وظیفه سنتز و ترشح هورمون پاراتیروئیدی (PTH) را برعهده و سلولهای اوکسیفیل در متابولیسم ویتامین D نقش دارند.
برای سنتز هورمونهای پاراتیروئیدی ژن این هورمون در هسته سلولهای اصلی رونویسی و mRNA آن بهوسیله آنزیمهای سیتوپلاسمی و ریبوزمها ترجمه میشود. دستگاه گلژی پس از ایجاد تغییرات در این پروتئین، هورمون را در وزیکولهای سیتوپلاسمی بستهبندی میکند. به همین دلیل تعداد زیادی وزیکول ذخیرهای (حاوی هورمون) در سیتوپلاسم این سلولها وجود دارد. هیپوکالسمیا (کاهش کلسیم خونی) مهمترین عامل تحریک گیرندههای سطحی سلولهای اصلی و ترشح و اگزوسیتوز وزیکولها است. اتصال کلسیم به این گیرنده در شرایطی که غلظت کلسیم خون طبیعی است، با تحریک واکنشهای درون سلولی اگزوسیتوز وزیکولها را مهار میکند.
تنظیم شیمیایی کلسیم خون
گیرنده PTH در غشای سلولهای ماهیچهای، استخوان، نفرون کلیه، کبد و لوله گوارش قرار دارد و با فعال کردن مسیر cAMP-پروتئین کیناز A در این سلولها، کلسیم خون را تنظیم میکند.
- اتصال هورمون-گیرنده در سلولهای استئوبلاست (سلولهای ذخیرهکننده کلسیم استخوان) استخوان ترشح مولکول Rank Ligand از این سلولها میشود. گیرنده این مولکول روی غشای استئوکلاستها (سلولهای آزادکننده کلسیم استخوان) قرار دارد. اتصال لیگاند-رسپتور ترشح اسید فسفاتازها و کاتاپسین k را افزایش میدهد. این آنزیمها هیدروکسی آپاتیت، کلاژن و سایر ترکیبات ماتریکس استخوان را تجزیه میکنند. یون کلسیم (
) و فسفات (
- ) حاصل از فعالیت این آنزیمها وراد خون میشود.
- اتصال هورمون-گیرنده در سلولهای لوله پیچ خورده دور نفرون رونویسی و ترجمه ژنهای کانالهای کلسیمی را تحریک میکند. در نتیجه بازجذب این یون از ادرار را افزایش مییابد. یون کلسیم بهوسیله انتقال فعال ثانویه و آنتیپورتر سدیم-کلسیم از سیتوپلاسم سلولهای نفرون وارد خون میشوند. در نبود هورمون غشای این بخش از توبول نفرون نفوذپذیری بسیار کمی به یونها دارد. همزمان با افزایش بازجذب کلسیم، دفع فسفات ادرار افزایش مییابد.
- اتصال هورمون-گیرنده در سلولهای توبول پروکسیمال کلیه سنتز و ترشح آنزیم ۱-آلفا-هیدروکسیلاز را تحریک میکند. این آنزیم ۲۵-دیهیدروکسی کولی کلسیفرول ساخته شده در کبد را هیدروکسیله (کربن ۱) میکند. ۱ و ۲۵-دیهیدروکسی کولی کلسیفرول یا کلسیتریول ساختار فعال ویتامین D در بدن است. ویتامین D در سلولهای دیواره دئودئوم مثل یک هورمون استروئیدی عمل میکند. اتصال این هورمون به گیرنده غشای هسته، رونویسی و بیان ژن کانالهای کلسیمی را افزایش میدهد. افزایش تعداد این کانالها در سطح لومنی سلولهای دئودئوم با افزایش جذب کلسیم از غذا و غظت خونی این یون همراه است.
نقش پانکراس در تنظیم شیمیایی
پانکراس یکی از غدد تنظیم شیمیایی بدن است که با سنتر و ترشح هورمونهای انسولین و گلوکاگون، غلظت گلوکز خون را کنترل میکند. این غده از دو بافت اندوکرین یا جزایز لانگرهان (سنتز هورمون | حدود ۱٪ از کل سلولهای پانکراس) و اگزوکرین (سنتز آنزیمهای گوارشی | حدود ۹۹٪ سلولهای پانکراس) تشکیل شده است. سلولهای آلفا و بتا در بافت اندوکرین وظیفه ترشح هورمونها را بر عهده دارند. سلولهای آلفا با سنتز هورمون گلوکاگون به افزایش غلظت گلوکز (پاسخ به هیپوگلایسمیا) و سلولهای بتا با سنتز انسولین به کاهش گلوکز خون (پاسخ به هایپرگلایسمیا) کمک میکنند.
سنتز و تنظیم انسولین
ژن کدکننده هورمون انسولین در هسته سلولهای بتای پانکراس قرار دارد. پروتئین سنتز شده از رونویسی و ترجمه mRNA این ژنها پس از تغییرات پس از ترجمه در دستگاه گلژی همراه پپیتید C در وزیکولهای ذخیرهای بستهبندی میشوند. افزایش گلوکز خون (بیش از ۱۲۰ میلیگرم در دسیلیتر خون) ورود گلوکز از ناقلهای Glut-2 در سلولهای بتا را افزایش میدهد. افزایش گلوکز سلولی با افزایش واکنشهای چرخه کربس و زنجیره انتقال الکترون تولید ATP در سلول را افزایش میدهد. ATP کانالهای پتاسیمی عرض غشا را مهار میکند و پتانسیل الکتریکی غشا افزایش مییابد (درون سلول مثبتتر از بیرون سلول). در نتیجه کانالهای کلسیمی باز و جریان
به سیتوپلاسم شروع میشود. افزایش کلسیم اگزوسیتوز وزیکولهای حاوی هورمون را تحریک میکند.
انسولین هورمونی پپتیدی و محلول در آب است که برای انتقال در خون به کمک پروتئینهای دیگر نیاز ندارد. گینده این هورمون در سطح غشای سلولهای کبدی، ماهیچهای و آدیپوسیتها (سلولهای چربی) وجود دارد.
- اتصال هورمون-گیرنده در سلولهای کبدی مسیر PI۳ و پروتئین کیناز B آنزیمهای مسیر گلیکوژنر را فعال و تبدیل گلوکز به گلیکوژن (کربوهیدرات ذخیرهای بدن) را افزایش میدهد. فعال کردن آنزیمهای مسیر تبدیل گلوکز به پیروات (گلیکولیز) یکی دیگر از فعالیتهای پروتئین کیناز B در سلولهای کبدی است. افزایش پیرووات با افزایش سرعت واکنشهای چرخه کربس و زنجیره انتقال الکترون، تولید ATP در سلولهای کبدی را افزایش میدهد.
- اتصال هورمون-گیرنده در سلولهای ماهیچه اسکلتی مسیر PI۳ و پروتئین کیناز B را فعال میکند. پروتئین کیناز B با فسفوریله کردن ناقل پروتئینی Glut-۴ انتقال گلوکز به سیتوپلاسم سلول را افزایش میدهد. در نتیجه واکنشهای گلیکولیز و تولید ATP در سلولهای ماهیچهای افزایش مییابد. به علاوه فسفوریلاسیون ناقل آمینواسیدی بهوسیله پروتئین کیناز B انتقال آمینواسیدها به سیتوپلاسم سلول را افزایش میدهد. در نتیجه سرعت پروتئینسازی در سلولهای ماهیچه اسکلتی افزایش مییابد. فسفوریلاسیون آنزیمهای مسیر گلیکوژنز بهوسیله پروتئین کیناز B سنتز پلیمر ذخیرهای گلیکوژن در ماهیچه را افزایش میدهد.
- اتصال هورمون-گیرنده در سلولهای چربی مسیر PI۳ و پروتئین کیناز B را فعال میکند. فسفوریلاسیون ناقل پروتئینی Glut-۴ بهوسیله پروتئین کیناز B، انتقال مولکولهای گلوکز به سیتوپلاسم سلولها را افزایش میدهد. فسفوریلاسیون آنزیمهای مسیر گلیکولیز و سنتز چربیها (لیپوژنز) سبب فعال شدن این دو مسیر در سلولهای چربی و افزایش تولید ATP و تریگلیسیرید (چربی ذخیرهای بدن) میشوند.
سنتز و تنظیم گلوکاگون
کاهش غلظت گلوکز در خون (کمتر از ۸۰ میلیگرم در دسیلیتر خون) انتقال گلوکز بهوسیله ناقلهای پروتئینی Glut-۱ به سیتوپلاسم سلولهای آلفا را کاهش میدهد. در نتیجه سرعت واکنشهای گلیکولیز و سنتز ATP در زنجیره انتقال الکترون کاهش مییابد. در نتیجه تغییرات اختلاف پتانسیل، دپلاریزاسیون غشای سلول و جریان یون کلسیم به سیتوپلاسم کاهش مییابد. اتصال اپینفرین یا نوراپینفرین اعصاب سمپاتیک، کوله سیستوکینین و سکرتین (هورمونهای سلولهای اندوکرین روده) دو عامل دیگری هستند که رونویسی، ترجمه و بستهبندی وزیکولهای حاوی گلوکاگون در سلولهای آلفای پانکراس را تحریک میکنند. کلسیم ورودی به سیتوپلاسم، اگزوسیتوز این وزیکولها و ترشح هورمون به خون را تحریک میکند.
افزایش گلوکز خون، ورود گلوکز از ناقل به سلول و سنتز ATP را افزایش میدهد. افزایش تولید ATP کانالهای پتاسیمی بیشتری را مهار میکند و دپلاریزاسیون غشا افزایش مییابد. در نتیجه کانالهای کلسیمی غشای سلول آلفا که اختلاف پتانسیل زیاد حساس هستند، بسته میشوند و ورود کلسیم و اگزوسیتوز مهار میشود. گیرنده این گلوکاگون در سطح سلولهای کبد، ماهیچههای قلبی و آدیپوسیتها قرار دارد.
- اتصال هورمون-گیرنده در سلولهای کبدی از مسیر cAMP و پروتئین کیناز A، آنزیم گلیکوژن فسفوریلاز را فعال میکند. در نتیجه تجزیه گلیکوژن به گلوکز (گلیکوژنولیز) افزایش مییابد. پروتئین کیناز آنزیمهای مسیر گلونئوژنز را نیز فعال میکند.
- اتصال این گیرنده-هورمون به سلولهای چربی از مسیر cAMP و پروتئین کیناز A، لیپاز حساس به هورمون (HSL) را فعال میکند. این آنزیم مولکولهای تریگلیسیرید را به گلیسرول و اسیدهای چرب تبدیل میکند. مولکول گلیسرول و اسیدهای چرب زوج کربن در سلولهای کبدی وارد مسیر گلیکونئوژنز میشود.
- اتصال هورمون-گیرنده در سلولهای میوکاردیوم قلب از مسیر cAMP و پروتئین کیناز A، سبب باز شدن کانلهای کلسیمی و ورود جریان کلسیم به سیتوپلاسم سلول ماهیچه قلبی میشود. در نتیجه انقباض و برونده قلب افزایش مییابد.
نقش غدد فوق کلیه در تنظیم شیمیایی
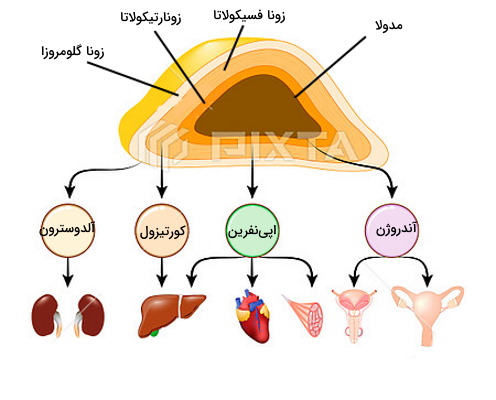
غدد فوق کلیه یا «آدرنال» (Adrenal) دو غده اندوکرین روی کلیهها هستند. هر یک از این غدهها از دوبخش قشری (کرتکس | Cortex) و مرکزی (مدولا | Medulla) تشکیل شده است. سلولهای اندوکرین بخش قشری و سلولهای عصبی در بخش مرکزی این غدد را میسازند. سنتز آلدوسترون، کورتیزول، گونادوکورتیکوئید و کتکولآمینها بر عهده این غدد است.
سنتز و تنظیم آلدوسترون
«زونا گلومروزا» (Zona Glomerulosa) خارجیترین لایه در کرتکس غدد فوق کلیه است که هورمون آلدوسترون را تولید و ترشح میکنند. کاهش فشار خون، هورمون تحریک کورتیکوتروپین و عوامل تحریک تولید و ترشح آلدوسترون هستند.
- کاهش فشار خون سبب ترشح آنزیم رنین از «سلولهای نزدیک گلومرولی» (Jaxa Glomeruli Cells) به خون میشود. این پروتئاز، آنژیوتانسینوژن (پروتئین ترشح شدI از کبد) را به آنژیوتانسین I تبدیل میکند. آنژیوتانسین I بهوسیله آنزیم آنژیتانسین کانورتاز (ترشح شده از ریه) به آنژیوتانسین II تبدیل میشود.
- سلولهای اندوکرین بخش زونا گلومروسا حساسیت زیادی به تغییرات غلظت سدیم خون دارند. کاهش غلظت سدیم (هایپونوترمیا) و افزایش پتاسیم (هایپوکلمیا) خون با تغییر پتانسیل الکتریکی سیتوپلاسم سبب تحریک تولید آلدوسترون میشود.
- هورمون آزادکننده کورتیکوتروپین به گیرندههای سطح سلولهای هیپوفیزی متصل میشود. این اتصال سبب تولید هورمون آدرنوکورتیکوتروپید در هیپوفیز و ترشح آن به خون میشود. استرسهای محیطی یکی از عوامل فعال شدن این مسیر تنظیم شیمیایی هستند.
اتصال آنژیوتانسین II و هورمون آدرنوکورتیکوتروپید به گیرنده آنها در سطح سلولهای بخش زونا گلومروسا از مسیر cAMP و پروتئین کیناز A، آنزیمهای مسیر متابولیکی تبدیل کلسترول به هورمون آلدوسترون را فعال میکند. افزایش فشار خون سبب ترشح پپتید دفع سدیم سرخرگی (Atrial natriuretic peptide | ANP) در خون میشود و اتصال این هورمون به گیرندههای سطح سلولهای قشر کلیه با تغییر پتانسیل الکتریکی سیتوپلاسم، مسیر متابولیکی سنتز آلدوسترون را مهار میکند.
آلدوسترون یکی از هورمونهای استروئیدی است که بخش اصلی انتقال آن در خون بهوسیله پروتئینها (آلبومین و گلوبین اتصالی به کوتیکواستروئید) در خون انجام میشود. اتصال آلدوسترون به گیرنده سیتوپلاسمی سلولهای دیواره در لوله پیچخورده دور نفرون رونویسی و ترجمه ژنهای پمپ سدیم-پتاسیم، کانالهای سدیمی و کانالهای پتاسیمی را افزایش میدهد. در نتیجه بازجذب سدیم و دفع پتاسیم در ادرار افزایش مییابد. بازجذب سدیم با بازجذب آب همراه است. در نتیجه حجم و فشار خون افزایش مییابد.
سنتز و تنظیم شیمیایی کورتیزول
«زونا فسیکولاتا» (Zona Fasciculata) لایه میانه کرتکس فوق کلیه است که سلولهای آن وظیفه تولید ترشح هورمون فوق کلیه را بر عهده دارند. اتصال هورمون آزادکننده کوتیکوتروپین (CRH) به گیرندههای سطح سلولهای هیپوفیز، تولید و ترشح هورمون کورتیکوتروپین آدرنال (ACTH) را تحریک میکند. گیرندههای ACTH در سطح سلولهای زونا فسکولاتا وجود دارد. اتصال هورمون-گیرنده در این سلولها از مسیر cAMP و پروتئین کیناز A، آنزیمهای مسیر سنتز کورتیزول از کلسترول را فعال میکند (کلسترول
پرگنلونونپروژسترون۱۷-هیدروکسی پروژسترون۱۱-دی هیدروکسی پروژسترون
کوتیزول).
حدود ۲۵٪ این هورمون استروئیدی بهوسیله آلبومین خون و ۷۵٪ باقیمانده بهوسیله گلوبین متصل شونده به کورتیکواستروئیدها (ترنس کورتین) در خون حمل و به ماهیچهها، سلولهای چربی، کبد و استخوان منتقل میشود. گیرندههای این هورمون در سیتوپلاسم سلولها قرار دارد.
- در سلولهای ماهیچه و استخوان، اتصال هورمون-گیرنده رونویسی ژنهای اکتین پپتیداز را فعال میکند.
- در سلولهای چربی، اتصال هورمون-گیرنده رونویسی ژنهای تریگلیسرازها را فعال میکند. تریگلیسراز شکسته شدن مولکولهای چربی را به گلیسرول و اسیدهای چرب را کاتالیز میکنند.
- اتصال هورمون-گیرنده در سلولهای کبد رونویسی ژن آنزیمهای مسیر گلوکونئوژنز را فعال میکند. این آنزیمها گلیسرول و آمینواسیدهای ایجاد شده از تجزیه پروتئینهای ماهیچه و استخوان را به گلوکز تبدیل میکنند. همچنین فعال شدن آنزیمهای مسیر گلیکوژنز، تشکیل پلیمر گلیکوژن در سلولهای کبدی را تحریک میکند. افزایش حساسیت سلولهای پاسخدهنده به اپینفرین یکی دیگر از اثرات افزایش غلظت کورتیزول در خون است.
- افزایش حساسیت ماهیچههای صاف دیواره رگ به اپینفرین منجر به افزایش انقباض ماهیچه و فشار خون میشود.
- افزایش حساسیت سلولهای کبدی به اپینفرین سبب افزایش تجزیه گلیکوژن به گلوکز میشود.
- اتصال هورمون-گیرنده در بازوفیلها، مونوسیت و لوکوسیتها، ترشح اینترلوکینها، هیستامین، پروستاگلاندین و لوکوترین را مهار و فعالیت سیستم ایمنی را کاهش میدهد.
هیپوگلایسمیا (کاهش غلظت گلوکز در خون) و استرس مزمن یا طولانی مدت از محرکهای سنتز کورتیزول در بدن است. افزایش کورتیزول در خون با مکانیسم بازخورد منفی، ترشح هورمون آزادکننده کورتیکوتروپین از هیپوتالاموس و مسیر تشکیل کورتیزول را مهار میکند.
سنتز و تنظیم شیمیایی هورمون های گونادوکورتیکوئید
«زونا رتیکولا» ( Zona Reticiculata) داخلیترین لایه کرتکس در غدد فوق کلیه است. سلولهای این بخش وظیفه سنتز و ترشح هورمونهای گونادو کوتیکوئید را بر عهده دارند. ترشح هورمون آزاد کننده کورتیکوتروپین از هسته پارا ونتیکولار هیپوتالاموس و اتصال آن به گیرندههای سلولهای هیپوفیز جلویی ترشح هورمون آدرنوکورتیکوتروپین را تحریک میکند. اتصال ای هورمون به گیرندههای سطح غشایی سلولهای زونا رتیکولا از مسیر cAMP و پروتئین کیناز A رونویسی ژن آنزیمهای مسیر سنتز گونادوکورتیکوئیدها (اندوستین دایون و دی هیدرو اپی اندسترون) از کلسترول را فعال میکند. در این شرایط کلسترول وارد دو مسیر سنتزی میشود.
- کلسترول $$$$ پرگنولونون
پروژستژستژون ۱۷-هیدروکسی پروژسترون
- اندروستین دایون
- کلسترول
پرگنولونون ۱۷-هیدروکسی پرگنولونون دی هیدرو اپی اندسترون یا ۱۷-هیدروکسی پروژسترون
- اندوستین دایون
این اندورژنهای ضعیف در مردان و زنان اثرات متفاوتی دارند. اندوستین دایون و دیهیدرو اپی اندسترون در بیضه مردان به تستسترون و در تخمدان زنان به استروژن تبدیل میشوند. این هورمونها مثل سایر اندروژنها ایجاد صفات ثانویه و بلوغ را تنظیم میکنند.
نقش تخمدان در تنظیم شیمیایی
مرکز اصلی تنظیم شیمیایی دستگاه تولید مثل در زنان هیپوتالاموس است. اتصال هورمون هستههای پریاپتیک هیپوتالاموس (هورمون آزادکننده گونادوتروپین) به بخش جلویی غده هیپوفیز، ترشح هورمونهای LH و FSH را تحریک میکند. فولیکولهای تخمدان از دو دسته سلول «گرانولوزا» (Granulosa) و «تیکا» (Theca) تشکیل میشود.
- اتصال FSH به گیرندههای سطح سلولی گرانولوزا مسیر بلوغ فولیکول را تحریک میکند.
- در فولیکولهای اولیه که از اووسیت متوقف شده در پروفاز I میوز و سلولهای اپیتلیال مکعبی اطراف آن تشکیل شده است، چند لایه شدن سلولهای پوششی دیواره، تشکیل لایه گلیکوزآمین زونا پلوسیدا، سنتز استروژن و تشکیل فولیکول ثانویه را تحریک میکند. پیشماده این مسیر سنتزی، استروژنهایی هستند که در سلولها تیکا تولید شدهاند. سنتز استروژن مثل مرحله قبل در این فولیکولها ادامه دارد.
- اثر هورمون بر فولیکول ثانویه علاوه بر تحریک میتوز و افزایش تعداد سلولهای اپیتلیال، تشکیل مایع فولیکولی (هیالورونیکاسید) و فولیکول ثانویه تاخیری را تحریک میکند.
- اتصال هورمون گیرنده در سلولهای فولیکول ثانویه تاخیری، اتصال حفرههای مایع فولیکولی به هم را تحریک میکند. در پایان این مرحله تنها یک حفره در این فولیکولها به نام «آنتروم» (Antrum) وجود دارد. سلولهای فولیکولی در پایان این مرحله در متافاز II میوز متوقف شده و فولیکول گرافن (Graafian Follicle) را میسازند. سلولهای این فولیکول با ترشح هورمون «اینهیبین» (Inhibin) ترشح هورمون FSH از هیپوفیز را مهار میکنند (انتهای مرحله فولیکولاسیون | حدود روز چهاردهم چرخه تخمکگذاری).
- اتصال LH به گیرندهای سطح سلولهای تیکا و گرانولوزا اثر متفاوتی دارد و در مراحل مختلف چرخه انجام میشود.
- سنتز اندوژنها از کلسترول را تحریک میکند. در نتیجه غلظت این هورمون در خون افزایش مییابد و بهوسیله مکانیسم بازخورد منفی تولید و ترشح هورمونهای تنظیمی از سیستم عصبی مرکزی را مهار میکند (میانه مرحله فولیکولاسیون | حدود روز هفتم چرخه تخمکگذاری). مهار FSH در انتهای چرخه فولیکولاسیون با افزایش ترشح LH از بخش جلویی هیپوفیز همراه است. افزایش LH نفوپذیری مویرگها اطراف آنتروم در فولیکول گرافن، مایع فولیکولی و بیان پروتئازها در سلول را افزایش میدهد. در نتیجه اووسیت ثانویه از فولیکول خارج میشود (تخمکگذاری | Ovulation).
- اتصال LH به گیرنده سلول گرانولوزا در فولیکول گرافن منجر به تمایز این سلولها، جذب مقدار زیاد کلسترول و تشکیل »جسم زرد» (Corpus Luteum) میشود (مرحله لوتئال | روز پانزدهم تا بیستوهشتم). این سلولها کارخانه تولید هورمونهای استروئیدی هستند. اتصال LH بر گیرنده این سلولها با تولید پروژسترون همراه است.
نقش استروژن و پروژسترون در تنظیم شیمیایی تولید مثل
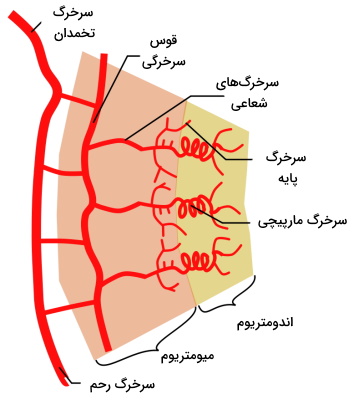
استروژن و پروژسترون سنتز شده بهوسیله تخمدان مرحله قاعدگی (Mensuration Phase)، مرحله بازسازی (Proliferative Phase) و مرحله ترشحی (Secretory Phase) چرخه رحم را تنظیم میکند. دیواره رحم (اندومتریوم) از دو لایه بافت پوششی استوانهای ساده (استراتوم فانکشنال و استراتوم بازال) تشکیل شده است که اتصال هورمونها به گیرنده درونسلولی این بافتها مراحل مختلف چرخه رحم و تولید مثل زنان را تنظیم میکنند.
- قاعدگی: این مرحله بین روزهای اول تا پنجم چرخه ایجاد میشود. در این مرحله سلولهای استراتوم فانکشنال از بین میروند و سلولهای جدا شده از دیواره به همراه خون مویرگها از رحم خارج میشوند.
- مرحله بازسازی: اتصال هورمون استروژن به گیرنده، تغییرات سلولی شروع این مرحله (روز ششم تا چهاردهم چرخه) را تحریک میکند. در این مرحله لایه استراتوم فانکشنال، مویرگهای آن و غدد اگزوکرین دیواره بازسازی میشود. اتصال استروژن-گیرنده در سلولهای مخاطی رحم ترشح لایه نازکی از مخاط در این قسمت را تحریک میکند. این لایه به حرکت اسپرم و فعال شدن آن کمک میکند.
- مرحله ترشحی: این مرحله معمولا روزهای پانزدهم تا بیستوهشتم چرخه تولید مثلی و با اتصال هورمون پروژسترون به گیرنده سلولهای دیواره رحم شروع میشود. در این مرحله افزایش تقسیم سلولی سبب افزایش ضخامت لایه استرتوم فانکشنال دیواره رحم، افزایش سرخرگهای این لایه و ترشح ترکیبات شیمیایی (ترکیبی گلیکوژن، لیپید و پروتئین) از غدد اندومتروم میشود. در حضور بلاستوسیت (توده سلولی در حال تقسیم پس از لقاح) افزایش غلظت پروژسترون در خون سبب افزایش ترشح موکوز از غدد اگزوکرین و تشکیل لایه مخاطی ضخیم در دهانه رحم میشود. این لایه از ورود پاتوژنها به رحم جلوگیری میکند.
در پایان هر چرخه رحم اگر لقاح انجام شود، ترشح هورمون گونادوتروپین مزمن از سلولها این اندام سنتز و ترشح هومرون پروژسترون از سلولهای جسم زرد (تا تشکیل جفت کامل | حدود هفته دوازدهم) را تحریک میکند. اما اگر لقاح انجام نشود، سنتز پروژسترون کاهش مییابد. تنظیم انقباض و انبساط ماهیچههای صاف دیواره مویرگهای استراتوم فانکشنال به هورمون پروژسترون وابسته است. کاهش پروژسترون منجر تغییر انبساط و انقباض این رگها و ضعیف شدن دیواره میشود. در نهایت از بین رفتن دیواره منجر به تشکیل لخته در استراتوم و توقف خونرسانی به بافت، ایسکمی و در نهایت نکروزه شدن استراتوم فانکشنال خواهد شد (قاعدگی). در این شرایط جسم زرد به بافت نکروزه شده به نام «جسم سفید» (Corpus Albican) تبدیل میشود.
نقش بیضه در تنظیم شیمیایی
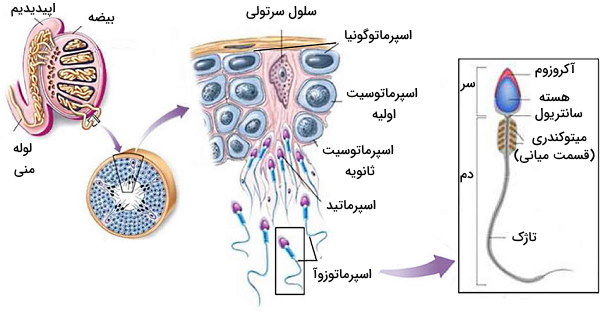
بیضهها دو غده اندوکرین برای تنظیم شیمیایی دستگاه تولید مثل مردان هستند. مرکز اصلی کنترل این غدهها مثل تخمدانها (غدد جنسی زنان) هیپوتالاموس و هیپوفیز در سیستم عصبی مرکزی است. اتصال هورمون آزادکننده گونادوتروپین (ترشح شده از هستههای پریاپتیک و آرکیوئت هیپوتالاموس) به گیرندههای سطح سلولهای گونادوتروپ در بخش جلویی هیپوفیز ترشح LH و FSH از این سلولها را تحریک میکند. بیضه مردان برای این هورمونها گیرنده دارد.
بیضهها از ساختارهای توبولی به نام «لولههای اسپرمساز» (Seminiferous tubule) تشکیل شده است که «تشکیل اسپرم» (Spermatogenesis) را بر عهده دارند. در دیواره این توبولها، «سلولهای سرتولی» (Sertoli Cells) با «اتصالات محکم» (Tight Junctions) و «اتصالات چسبنده» (Adherents junctions) کنار هم قرار میگیرند. اتصالات بین سلولی در این بخش سدی بین مویرگهای خونی و لومن توبول ایجاد میکنند. اسپرماتوگونیا، سلولهای بنیادی و ۴۶ کروموزومی هستند که در سطح بازال (سطح نزدیک به غشای پایه و مویرگها) سلولهای سرتولی قرار دارند. از تقسیم میتوز این سلولها دو دسته سلول ایجاد میشود که دسته اول تقسیم میتوز را ادامه میدهند و دسته دوم (اسپرماتوسیت اولیه) پس از عبور از اتصالات محکم (که به دلیل ترشحات سرتولی باز شدهاند) در لومن توبولها وارد تقسیم میوز میشوند. در پایان میوز I این سلولها، اسپرماتوسیت ثانویه و در پایان میوز II اسپرماتید تشکیل میشود. اسپرماتیدها پس از تغییرات مورفولوژی به اسپرماتوزوآ یا اسپرم تمایز مییابند. تنظیم این مسیر به ترشح LH ،FSH و تستسترون نیاز دارد.
- اتصال LH به گیرندههای سطح «سلولهای لایدیگ» (Leydig Cells) رونویسی ژن آنزیمهای مسیر تبدیل کلسترول به هورمون تستسترون را تحریک میکند. بخشی از این هورمون وارد لومن لولههای اسپرمساز میشود و با اثر بر اسپرماتوسیتهای اولیه مسیر تشکیل اسپرم را تحریک میکند. بخشی از این هورمون به بافتهای دیگر منتقل میشود و در ایجاد صفات مردانه نقش دارد. افزایش غلظت این هورمون در خون با اثر بر هیپوتالاموس ترشح LH را مهار میکند (مکانیسم بازخورد منفی).
- اتصال FSH به گیرنده سطح بازال سلولهای سرتولی، رونویسی و ترجمه ژنهای پروتئین اتصالی به اندروژنها را تحریک میکند. این پروتئین با اتصال به تستسترون آبگریزی این مولکول را کاهش و فراوانی آن در لومن توبولها را افزایش میدهد. گیرندههای سطح سلولهای سرتولی افزایش اسپرم در لومن را تشخیص میدهند و سیگنال این گیرندهها سنتز و ترشح هورمون اینهیبین را تحریک میکند. اتصال این هورمون به گیرندههای سطح سلولهای هیپوتالاموس، ترشح FSH را مهار میکند (مکانیسم بازخورد منفی).
بیماری های سیستم تنظیم شیمیایی
در بخشهای قبلی اجزای مختلف سیستم تنظیم شیمیایی در بدن را بررسی کردیم. بسیاری از فرایندهای بدن از واکنشهای مولکولی تا حرکت دادن دست و پا نیاز پیامهای سیستم تنظیم شیمیایی بدن دارد. اختلالهای ژنتیکی، فیزیولوژیکی و عوامل محیطی مختلفی با تغییر عملکرد غدد، گیرندههای سلولی، ساختار هورمون یا مراکز تنظیمی مرکزی، عملکرد این سیستم را مختل میکنند. در این بخش تعدادی از بیماریهای متداول سیستم تنظیم شیمیایی بدن را توضیح میدهیم.
کم کاری تیروئید
عوامل مختلفی در بدن سبب تغییر فعالیت غده تیروئید و کاهش ترشح T4 و T3 میشوند. «کمکاری تیروئید اولیه» (Primary Hypothyroidism)، کم کاری تیروئید مرکزی و کمکاری تیروئید بدو تولد سه نوع اختلال تیروئیدی هستند که منجر به کاهش تولید هورمونهای T۴ و T۳ میشوند. کمکاری تیروئید اولیه به دلیل بیماریهای خودایمنی، ویروسها، مصرف برخی داروها و تغییر غلظت ید در بدن ایجاد میشود.
- بیماریهای خودایمنی: عوامل ژنتیکی و فیزیولوژیکی مختلفی سبب میشود سیستم ایمنی سلولهای تیروئیدی را به عنوان پاتوژن شناسی و علیه آن آنتیبادی تولید کند.
- «هاشیموتو» (Hashimoto’s disease): یکی از انواع بیماری خودایمنی است که فراوانی آن در زنان بیشتر از مردان است. در این بیماری سیستم ایمنی فولیکولهای تیروئیدی را به عنوان پاتوژن میشناسد و برای از بین بردن آنها آنتیبادی ترشح میکند. جهش در ژنهای HLADR-۳ و HLADR-۵ (ژنهای گیرنده سلولهای ایمنی) منجر به ایجاد این بیماری میشود. هاشیموتو یکی از اختلالهای مزمن دستگاه تنظیم شیمیایی بدن است.
- «اختلال تیروئیدی پس از زایمان» (Postpartum Hypothyroidism): در زمان بارداری حساسیت سیستم ایمنی کاهش مسیابد. پس از زایمان فعالیت این سیستم به شکل سابق ادامه دارد. اما در مواردی ممکن است با ایجاد اختلال همراه شود. این اختلال معمولا موقتی است و معمولا پس از مدتی بدن به تعادل بر میگردد.
- (Riedel’s thyroiditis) تولید و ترشح آنتیبادیهای جی ۴ (IgG۴) فیبروبلاستهای اطراف غده تیروئید را فعال میکند. فیبروبلاستهای فعال بافت ترشحکننده هورمون را به بافتهای فیبروزی تبدیل میکنند و سنتز T۴ و T۳ را کاهش میدهند.
- ویروس ها: ویروسها سبب ایجاد «کمکاری تیروئیدی گراماتولوز نیمهحاد» (Subacute Granulomatous Thyroiditis) در بیمار میشوند. این اختلال سبب افزایش التهاب بدن و سنتز پروتئینی در کبد میشود که سرعت رسوب گلبولهای قرمز در آزمایش خون را افزایش میدهد.
- داروها: مصرف برخی داروها عملکرد غده تیروئید را تغییر میدهد. آمیودرون (Amiodarone | داروی تنظیم ریتم قلب)، لیتیوم (داروی درمان بیماری دوقطبی) و
- (داروی درمان پرکاری تیروئید که فولیکولهای سازنده هورمون را از بین میبرد) ازجمله داروهایی هستند که منجر به کمکاری تیروئید میشوند.
- تغییر غلظت ید: افزایش یا کاهش زیاد ید در بدن یکی دیگر از عوامل ایجاد اختلال هیپوتیروئید یا کمکاری غده تیروئید است. کاهش ید سبب کاهش تولید هورمونهای تیروئیدی میشود. کمبود ید عامل اصلی ایجاد کمکاری تیروئید در جهان است. افزایش یون ید در بدن سنتز T۴ و T۳ را با مهار آنزیم تیروئید پروکسیداز و پروتئازها مهار میکند (Wolff–Chaikoff effect).
در بخشهای قبلی توضیح دادیم، هیپوتالاموس مرکز اصلی کنترل تنظیم شیمیایی بدن است. به همین دلیل اختلال در عملکرد این بخش، بر تولید و ترشح هورمونها در غدههای مختلف اثر دارد. کاهش هورمون آزادکننده تیروتروپین یا هورمون تحریک تیروئید (ضربه به سر، تومورهای مغزی یا سندروم شیهان) تولید هورمونهای تیروئیدی را کاهش میدهد.
کمکاری تیروئیدی بدو تولد به دلیل اختلال در تکامل غده تیروئید جنین یا به دلیل کاهش یون ید در بدن مادر ایجاد میشود. اختلال آنتیبادیهای بدن مادر، «تشکیل نشدن غده تیروئید» (Thyroid Agenesis) یا «نقص در تشکیل غده تیروئید» (Thyroid Dysgenesis)، جهش ژن آنزیم تیروئید پروکسیداز و کمبود ید یون در بدن مادر از تکامل غده تیروئید جنین و در نتیجه سنتز هورمونهای تیروئیدی را مختل میکند.
از آنجا که تنظیم شیمیایی بسیاری از مسیرهای متابولیکی بر عهده این هورمونها است، اختلال در عملکرد آنها اثرات بسیاری در اندامهای مختلف و هومئوستازی کل بدن دارد.
- بزرگشدن غده تیروئید یا «گواتر» (Goiter) یکی از متدوالترین علائم این بیماری در مبتلایان است. این اختلال ممکن است به دلیل آزاد نشدن هورمونها به خون (بر اثر از بین رفتن بخشی از بافت تیروئید یا کمبود ید) ایجاد شود. در این حالت تایروگلوبین سنتز شده در لومن تیروئید جمع میشود.
- در این شرایط فعالیت متابولیکی سلولها (گلیکولیز، لیپولیز، گلیوکوژنولیز، سنتز ATP و انرژی گرمایی) کاهش مییابد. به همین دلیل این بیماری با افزایش وزن بیمار و کاهش دمای بدن همراه است.
- با کاهش این هورمون، فرایند افزایش حساسیت سلولهای قلبی (افزایش گیرندههای بتا آدرنرژیک سطح غشا) به اپینفرین و نورواپینفرین مختل میشود. در نتیجه ضربان قلب افراد مبتلا به کمکاری تیروئد آهستهتر از سایر افراد است.
- کاهش این هورمون با اختلال در تنظیم فعالیت استئوبلاستها و استئوکلاستها رشد استخوان را کاهش می دهد. در نتیجه کودکان مبتلا به این بیماری اسکلت کوتاهتری دارند.
- کاهش این هورمون در سیستم عصبی مرکزی به دلیل کاهش فعالیت نورونهای سمپاتیک، با افزایش احتمال ابتلا به افسردگی، ضعف اعصاب، احساس خستگی زیاد و کاهش حافظه همراه است. به علاوه پاسخ این بیماران به رفلاکس آهستهتر از سایر افراد است (Woltman’s Sign).
- کاهش هورمونهای تیروئیدی در لوله گوارش با کاهش ترشح مواد دیوراه (آنزیم، اسید، مخاط و الکترولیتها) و حرکات این لوله منجر به یبوست میشود.
- کاهش T۳ و T۴ در ماهیچههای اسکلتی با کاهش توانایی بازسازی و خودترمیمی سلولها و در نتیجه «آسیب بافت ماهیچهای» (Myopathy) همراه است. در این شرایط سنتز و ترشح آنزیم کراتین کیناز خون افزایش مییابد. به علاوه کاهش پروتئینسازی منجر به ضعیف شدن و کاهش انقباض ماهیچهها خواهد شد.
- کاهش هورمون تیروئید با کاهش جریان خون در پوست منجر به کاهش اکسیژنرسانی و تغذیه فولیکول مو میشود. در نتیجه ریزش مو در افراد مبتلا به کمکاری تیروئید افزایش مییابد. به علاوه این افراد ناخنهای کبود و پوست خشکی دارند.
- کاهش این هورمونها در کبد با کاهش رسپتورهای LDL در سطح هپاتوسیتها منجر به افزایش کلسترول و تریگلیسیرید خون میشود.
- کاهش T۴ و T۳ با مکانیسم بازخورد منفی، تولید و ترشح هورمون TRH را افزایش میدهد. این هورمون با اثر بر سلولهای هیپوفیز ترشح TSH و پرولاکتین را افزایش خواهد داد. پرولاکتین افزایش یافته، تولید هورمونهای LH و FSH را مهار میکند. در نتیجه هورمونهای تیروئیدی به طور غیرمستقیم در تنظیم هورمونهای جنسی نقش دارند.
- کاهش این هورمون تجزیه گلایکوزآمینوگلایکانهای سنتز شده بهوسیله فیبروبلاست را کاهش می دهد. در نتیجه تجمع این مولکول در بافت اطراف چشم، پوست و «کانال کارپال» (Carpal Tunnel) در مچ دست با افزایش جذب آب منجر به ایجاد ادم میشود.
پر کاری تیروئید
پرکاری تیروئید یا «هایپرتیروئیدیسم» (Hyperthyroidism) به وضعیت پاتولوژیکی گفته میشود که سنتز و ترشح هورمونهای تیروئیدی در بدن افزایش مییابد. این اختلال ممکن است به دلیل اختلال در غده تیروئید یا مرکز کنترل این غده (هیپوتالاموس و هیپوفیز) ایجاد شود. «بیماری گریو» (Graves’ Disease)، «آدنومای سمی» (Toxic Adenoma) و «گواتر چند نودولی» (Toxic Multi-nodular Goiter | TMG) سه دلیل اصلی ایجاد پرکاری تیروئید اولیه و تورمورهای هیپوفیز، افزایش هورمون hCG دلایل اصلی ایجاد پرکاری تیروئید ثانویه هستند.
- بیماری گریو: بیماری گریو یک بیماری خودایمنی است. در این بیماری جهش ژنهای HLA-B8 و HLADR 3 سبب میشود سیستم ایمنی سلولهای بدن (گیرندههای TSH) را به عنوان پاتوژن شناسایی و علیه آنها آنتی بادی تولید کند. اتصال این آنتیبادیها به گیرنده افزایش تولید هورمونهای T۴ و T۳ را به همراه دارد. به علاوه این آنتیبادیها با تحریک سلولهای T و تولید اینترلوکین آلفا و گاما، تولید گلیکوزآمینوگلایکانها از فیبروبلاست را افزایش میدهند. افزایش این مولکولها با افزایش جذب آب و ادم اطراف آدیپوسیتها و سلولهای ماهیچهای اطراف چشم همراه است. در نتیجه کره چشم در این بیماران بیرون میزند (برونچشمی یا اگزوفتالمی | Exophthalmos).
- آدنومای سمی و گواتر چند نودولی: در این دو بیماری جهش گیرنده TSH سبب ایجاد ویژگی خودتحریکی در این گیرندهها و در نتیجه افزایش سنتز و ترشح هورمونهای تیروئیدی میشود.
- تومورهای هیپوفیز: آدنومای هیپوفیز با افزایش سلولهای ترشحکننده هورمون TSH سنتز و غلظت هورمون های تیروئیدی در خون را افزایش می دهد.
- افزایش هورمون hCG: «هورمون گونادوتروپین مزمن» (Human Chorionic Gonadotropin | hCG) در دوران بارداری بهوسیله سلولهای جفت تشکیل میشود و با افزایش ضخامت سلولهای پوششی دیواره به نگهداری جفت کمک میکند. تومورهای رحم تولید و ترشح این هورمون در مواقع غیربارداری را بسیار افزایش میدهند. غلظت بسیار بالای این هورمون در خون عملکردی شبیه به TSH دارد و سنتز هورمونهای تیروئیدی را افزایش میدهد.
افزایش غلظت هورمونهای تیروئیدی خون نیاز بدن به تولید ATP (گلیکوژنولیز، گلیکولیز، لیپولیز و انرژی گرمایی) را افزایش میدهد. فزایش متابولیسم بدن با ورود تریگلیسریدهای ذخیرهای به مسیرهای لیپولیز با کاهش وزن همراه است. T۴ و T۳ افزایشیافته بر عملکرد سلولهای کبدی، ماهیچه اسکلتی، ماهیچه قلب، استخوان، اعصاب سمپاتیک و پوست نیز اثر دارد.
- ماهیچه قلب: افزایش حساسیت قلب به اپینفرین و نوراپینفرین (افزایش گیرندههای سلولی) منجر به افزایش ضربان قلب یا تاکیکاردی، برونده قلب و افزایش فشار خون میشود.
- استخوان: افزایش این هورمون با افزایش فعالیت آنزیمهای استئوکلاستها، ذخیره کلسیم ماتریکس استخوان را کاهش و احتمال ابتلا به بیماری پوکی استخوان را افزایش میدهد.
- اعصاب سمپاتیک: افزایش هورمون تیروئیدی با افزایش سیناپسهای سیستم عصب سمپاتیک اضطراب، پرخاشگری، تحریکپذیری و بیخوابی را افزایش میدهد. به علاوه افزایش تحریک ماهیچههای پلک سبب گشادی چشم در این افراد میشود.
- لوله گوارش: افزایش ترشحات و حرکان لوله گوارش منجر به ایجاد اسهال و کاهش حجم خون (به دلیل دفع آب) میشود.
- پوست: افزایش جریان خون در پوست این افراد، سبب قرمز دیده شدن پوست، افزایش تعریق و احساس گرما میشود.
- ماهیچه اسکلتی: افزایش هورمون با افزایش فعالیت و انقباض ماهیچهها همراه است. در این شرایط ماهیچه فرصت کمی برای استراحت دارد و آسیب میشود. افزایش التهاب در سلول مثل کمکاری تیروئید، سنتز و ترشح آنزیم کراتین کیناز در خون را افزایش میدهد.
- کبد: افزایش سنتز هورمونهای تیروئیدی همزمان با افزایش سنتز گلوبینهای اتصالی به T4 و T3، سنتز گلوبینهای اتصالی به گونادوهورمونها (استروژن و پروژسترون) را افزایش میدهد. در نتیجه غلظت این هورمونها در خون و اثر آنها بر گونادها کاهش مییابد. به علاوه تعداد گیرندههای LDL در هپاتوسیتها افزایش و کلسترول خون کاهش مییابد.
دیابت شیرین
دیابت شیرین یا «دیابت ملیتوس» (Diabetes Mellitus) یکی از بیماریهای تنظیم شیمیایی بدن است که با اثر بر سلولهای اندوکرین پانکراس (هورمون کافی تولید نمیشود) یا گیرندههای سلول هدف (سلول نمیتواند هورمون را دریافت کند)، تنظیم گلوکز را مختل میکند. این بیمار خودایمنی به دلیل آلودگی بدن با ویروس یا جهش در ژنهای ALH DR 3/4 ایجاد میشود. در دیابت ملیتوس نوع I آنتیبادیهای سیستم ایمنی سلولهای بتا را به عنوان پاتوزن شناسایی و به گیرنده این سلولها متصل میشود. با تخریب سلولهای بتا ترشح انسولین کاهش و ناقلهای وابسته به انسولین نمیتوانند گلوکز را به سیتوپلاسم سلول انتقال دهند. در نتیجه غلظت گلوکز در خون افزایش مییابد.
چاقی و افزایش وزن یکی از عوامل اصلی ایجاد دیابت ملیتوس نوع II است. در این بیماری سلولهای بتا انسولین کافی تولید میکنند. اما گیرندههای سطح سلولی به هومرون پاسخ نمیدهند (Insulin Resistance). دلیل مقاومت گیرندههای سلولی در پاسخ به انسولین مشخص نیست. اما سابقه خانوادگی ابتلا به دیابت، چاقی (به خصوص چاقی شکمی) و کمتحرکی از نشانههای پرتکرار در بیماران مبتلا به این بیماری مباتوبیکی هستند. در نتیجه واکنشهای آنزیمی فعالکننده کانالهای انتقال گلوکز و ورود این قند به سلول مهار میشود. با گذشت زمان و افزایش غلظت انسولین در خون، ترشح این هومرون از سلولهای بتای پانکراس کاهش مییابد.
افزایش گلوکز خون منجر به افزایش فیلتراسیون گلومرولی در نفرونهای کلیه میشود. افزایش غلظت این مولکول در ادرار (گلوکویوریا) با افزایش اسمولاریته ادرار با ترشح آب از مویرگها به نفرون همراه است. به علاوه غلظت زیاد گلوکز در خون و کاهش آب (به دلیل پلییوریا) اسمولاریته خون را افزایش میدهد (هایپراسمولاریتی خون). در این شرایط تحریک گیرندههای اسمزی (اسمورسپتورها) هیپوتالاموس منجر به افزایش احساس تنگی در فرد میشود. در نتیجه تکرر ادرار (پلییوریا) و تشنگی زیاد یکی از علائم این بیماری است. در دیابت شیرین سلول نمیتواند از گلوکز به عنوان منبع اصلی تولید ATP استفاده کند. به همین دلیل مسیرهای کاتابولیسمی چربی در آدیپوسیتها (تولید اسیدهای چرب و گلیسرول) و پروتئین ماهیچهها (تولید آمینواسید) برای تولید ATP فعال میشود. در نتیجه وزن بدن کاهش مییابد.
جمع بندی
در این مطلب توضیح دادیم که تنظیم شیمیایی بدن به سنتز مولکولهای شیمیایی به نام هومرون از غدد اندوکرین وابسته و مرکز کنترل این غدهها هیپوتالاموس در سیستم عصبی مرکزی است. ساختار هومرونها از دو دسته مولکولهای زیستی (پروتئین و استروئید) تشکیل شده است و نوع انتقال پیام بهوسیله این مولکولها متفاوت است. هورمونهای پروتئینی نامحلول در غشای پلاسمایی هستند و گیرنده آنها در سطح سلول قرار دارد. به همین دلیل انتقال پیام آنها با کمک پیک ثانویه انجام میشود. اما هورمونهای استروئیدی (محلول در چربی) نیاز به پیک ثانویه ندارند. تنظیم قند و کلسیم خون، تنظیم تخمکگذاری و اسپرماتوژنز، تنظیم رشد استخوانها و ماهیچه، تنظیم خواب و دفع ادرار از فرایندهایی هستند که تنظیم شیمیایی آنها بر عهده هورمونها است.





