کربن عنصر شیمیایی غیرفلزی است که در گروه ۱۴ جدول تناوبی قرار دارد. اگرچه این عنصر به طور گسترده در طبیعت پراکنده شده است و پانزدهمین عنصر فراوان پوسته زمین است ولی تنها ۰٫۰۲۵ درصد از عناصر پوسته زمین را تشکیل میدهد. این عنصر نسبت به سایر عناصر پوسته زمین، بیشتر به صورت ترکیب با عناصر دیگر دیده میشود. در این مطلب عنصر کربن به همراه ویژگیها و کاربردهای آن توضیح داده خواهد شد.
عنصر کربن چیست ؟
عنصر کربن با نماد شیمیایی C و عدد اتمی ۶ در گروه ۱۴ جدول تناوبی قرار گرفته است. این عنصر غیرفلزی و چهارظرفیتی است، به این معنی که میتواند ۴ الکترون جفت نشده برای برقراری پیوند کووالانسی به اشتراک بگذارد.
نام این عنصر از واژه لاتین «Carbo» به معنی ذغال گرفته شده است. زغال چوب رایجترین شکل کربن است. هنگامی که چوب در غیاب اکسیژن گرم شود، زغال چوب را تشکیل میدهد. فیزیکدان فرانسوی «رنه رامور» (René Reaumur)، متوجه شد که زغال یا همان کربن ممکن است یک عنصر باشد و در سال ۱۷۲۲ میلادی مقالهای در این زمینه منتشر کرد. در طبقهبندی عناصر که در اواخر قرن ۱۸ انجام شد نیز نام کربن را براساس نام ذغال چوب انتخاب کردند.
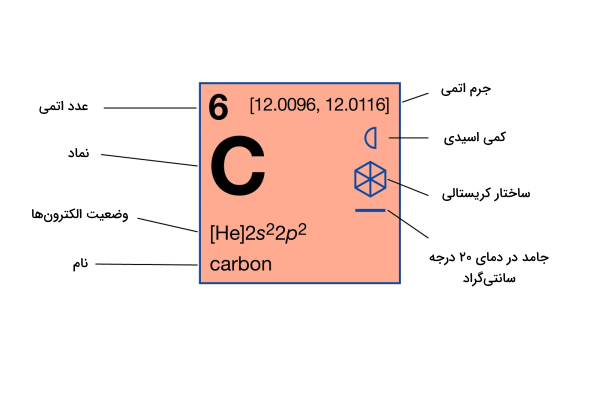
کربن یکی از معدود عناصر شناخته شده از دوران باستان است و از نظر جرم چهارمین عنصر فراوان در جهان پس از هیدروژن، هلیوم و اکسیژن است. تنوع منحصر به فرد ترکیبات آلی این عنصر و توانایی آن برای تشکیل پلیمرها در دمایی معمول زمین، این عنصر را قادر میسازد تا به عنوان عنصر مشترک حیات عمل کند. این عنصر دومین عنصر فراوان در بدن انسان از نظر جرمی (حدود ۱۸٫۵٪) پس از اکسیژن است. سایر ویژگیهای عنصر کربن در جدول زیر نوشته شدهاند.
| ویژگیهای شیمیایی عنصر کربن | |
| عدد اتمی | ۶ |
| جرم اتمی میانگین | ۱۲٫۰۱۱ g/mol |
| الکترونگاتیوی | ۲٫۵ |
| چگالی | ۲٬۲ g/cm³ در ۲۰ درجه سانتیگراد |
| نقطه ذوب | ۳۶۵۲ درجه سانتیگراد |
| نقطه جوش | ۴۸۲۷ درجه سانتیگراد |
| انرژی یونش اول | ۱۰۸۶٫۱ KJ/mol |
| انرژی یونش دوم | ۲۵۵۱٫۹ KJ/mol |
| انرژی یونش سوم | ۴۶۱۸٫۸ KJ/mol |
| انرژی یونش چهارم | ۶۲۲۲٫۷ KJ/mol |
کربن ششمین عنصر جدول تناوبی است بنابراین الکترونهای حالت پایه آن به صورت
هستند که چهار الکترون بیرونی آن یعنی الکترونهای موجود در اوربیتالهای ۲s و ۲p، الکترونهای لایه ظرفیت آن را تشکیل میدهند.
انرژی یونش اول عنصر کربن برابر با ۱۰۸۶٫۵، دوم برابر با ۲۳۵۲٫۶، سوم برابر با ۴۶۲۰٫۵ و انرژی یونش چهارم آن ۶۲۲۲٫۷ کیلوژول بر مول است که بسیار بیشتر از انرژی یونش لازم برای عناصر سنگینتر گروه ۱۴ است. الکترونگاتیوی کربن ۲٫۵ است که باز هم به طور قابل توجهی بالاتر از عناصر سنگین گروه خود است.
شعاع پیوند کووالانسی کربن کربن برای پیوند یگانه (C−C) معمولا ،۷۷٫۲ pmبرای پیوند دوگانه (C=C) برابر با ۶۶٫۷ pm و برای پیوند سهگانه (C≡C) ۶۰٫۳ pm در نظر گرفته میشود. اگرچه ممکن است بسته به میزان «عدد کوئوردیناسیون» (Coordination Number) و عنصری که کربن به آن متصل است، میزان متفاوتی را اتخاذ کند. به طور کلی، شعاع پیوند کووالانسی با عدد کوئوردیناسیون کمتر و افزایش مرتبه پیوند، کاهش مییابد.
ایزوتوپ های عنصر کربن چیست ؟
۱۵ ایزوتوپ برای کربن تا به امروز شناخته شده است که شامل کربن ۸ تا کربن ۲۲ هستند. در میان این ایزوتوپها، سه ایزوتوپ طبیعی وجود دارد که شامل ایزوتوپهای پایدار کربن ۱۲، کربن ۱۳ و ایزوتوپ ناپایدار و رادیواکتیو کربن ۱۴ میشوند. نیمه عمر ایزوتوپ کربن ۱۴ برابر با ۵۷۳۰ سال است.

در میان ایزوتوپهای مصنوعی کربن، ایزوتوپ کربن ۱۱ پایدارترین است که نیمه عمری برابر با ۲۰٫۳۴۰۲ دقیقه دارد. سایر ایزوتوپهای مصنوعی کربن، نیمهعمری کمتر از ۲۰ ثانیه دارند. ناپایدارترین ایزوتوپ کربن را کربن ۸ تشکیل میدهد که نیمهعمر آن برابر با ۳٫۵ زتاثانیه است (
). انواع ایزوتوپهای عنصر کربن به همراه ویژگیهای آنها در جدول زیر مشخص شدهاند. پایدارترین ایزوتوپ کربن، کربن ۱۲ است که ۹۹٪ از از کل کربن روی زمین را تشکیل میدهد. کربن ۱۳ یک درصد از کربنهای روی زمین را تشکیل میدهد و کربن ۱۴ بسیار نادر است. از هر تریلیون اتم کربن فقط یک اتم کربن ۱۴ وجود دارد.
| ایزوتوپ کربن | عدد اتمی | تعداد نوترون | جرم اتمی | نیمهعمر | واپاشی هستهای | ایزوتوپ دختری |
| کربن ۸ | ۶ | ۲ | ۸٫۰۳۷ | ۳٫۵ زتاثانیه | ۲p |
| کربن ۹ | ۶ | ۳ | ۹٫۰۳۱ | ۱۲۶٫۵ ms |
| کربن ۱۰ | ۶ | ۴ | ۱۰٫۰۱۶ | ۱۹٫۳۰۱۱ s |
| کربن ۱۱ | ۶ | ۵ | ۱۱٫۰۱۱ | ۲۰٫۳۴ min |
| کربن ۱۲ | ۶ | ۶ | ۱۲ | پایدار | ||
| کربن ۱۳ | ۶ | ۷ | ۱۳٫۰۰۳ | پایدار | ||
| کربن ۱۴ | ۶ | ۸ | ۱۴٫۰۰۳ | ۵۷۰۳ سال | ||
| کربن ۱۵ | ۶ | ۹ | ۱۵٫۰۱۰ | ۲٫۴۴۹ s |
| کربن ۱۶ | ۶ | ۱۰ | ۱۶٫۰۱۴ | ۷۵۰ ms |
| کربن ۱۷ | ۶ | ۱۱ | ۱۷٫۰۲۲ | ۱۹۳ ms |
| کربن ۱۸ | ۶ | ۱۲ | ۱۸٫۰۲۶ | ۹۲ ms |
| کربن ۱۹ | ۶ | ۱۳ | ۱۹٫۰۳۴ | ۴۶٫۲ ms |
| کربن ۲۰ | ۶ | ۱۴ | ۲۰٫۰۴۰ | ۱۶ ms |
| کربن ۲۱ | ۶ | ۱۵ | ۲۱٫۰۴۹ | ۳۰ ns | مشخص نیست. | |
| کربن ۲۲ | ۶ | ۱۶ | ۲۲٫۰۵۷ | ۶٫۲ ms | ||
از ایزوتوپ کربن ۱۴ چه استفادهای میشود ؟
به دلیل خاصیت رادیواکتیو و نیمهعمر بالای این ایزوتوپ، از آن برای مطالعات باستانشناسی و به عنوان نشانگر کربن در مطالعات زیستی و شیمیایی استفاده میشود.
نحوه ایجاد کربن ۱۴ در طبیعت چگونه است ؟
اشعههای کیهانی در مقیاس وسیعی وارد اتمسفر کره زمین میشوند. برای مثال هر فرد در هر ساعت تحت تابش نیم میلیون اشعه کیهانی قرار میگیرد. پرتوهای کیهانی با اتمهای موجود در جو زمین برخورد میکنند و پرتو کیهانی ثانویه به شکل نوترون پرانرژی را ایجاد میکنند. نوترونهای پرانرژی میتوانند با اتمهای نیتروژن برخورد کنند و اتم نیتروژن ۱۴ (هفت پروتون، هفت نوترون) را ایجاد کنند. سپس نیتروژن ۱۴ به اتم کربن ۱۴ (شش پروتون، هشت نوترون) و اتم هیدروژن (یک پروتون، صفر نوترون) تبدیل میشود.
چگونه از کربن ۱۴ برای تخمین تاریخ مرگ موجودات استفاده میشود ؟
اتمهای کربن ۱۴ که پرتوهای کیهانی ایجاد میکنند با اکسیژن موجود در اتمسفر ترکیب میشوند و
را ایجاد میکنند. گیاهان
را جذب کرده و با فتوسنتز وارد بافتهای خود میکنند. حیوانات و انسانها گیاهان را میخورند و کربن ۱۴ را نیز به همراه آنها دریافت میکنند.
نسبت کربن-۱۲ به کربن-۱۴ در همه موجودات زنده در هر زمان معین تقریبا ثابت است. از هر تریلیون اتم کربن یک اتم، کربن ۱۴ است. اتمهای کربن ۱۴ همیشه در حال فروپاشی هستند، اما با سرعت ثابتی با اتمهای کربن ۱۴ جدید جایگزین میشوند. بدن انسان و همه گیاهان و جانوران زنده دارای درصد مشخصی اتم کربن ۱۴ است.
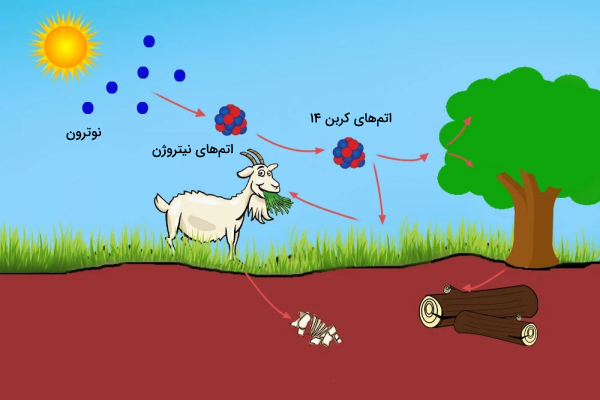
هنگامی که موجود زنده میمیرد دیگر کربن ۱۴ جدیدی جایگزین کربنهای واپاشی شده خود نمیکند. به همین جهت کربن ۱۴ موجود در بدن دچار واپاشی میشود و نسبت کربن ۱۲ به ۱۴ افزایش مییابد. بر همین اساس باستانشناسان میتوانند سن فسیلها را تخمین بزنند. آنها برای این کار از فرمول زیر استفاده میکنند.
در این فرمول
برابر با نسبت درصد کربن ۱۴ در نمونه در درصد کربن ۱۴ در موجودات زنده است و
برابر با نیمه عمر کربن ۱۴ است که برابر با ۵۷۰۰ سال میشود. برای مثال، عمر فسیلی را که تنها ۱۰ درصد کربن ۱۴ نسبت به نمونه زنده دارد از طریق فرمول بالا ۱۸۹۴۰ سال بدست میآید.
از آنجایی که نیمه عمر کربن ۱۴، در حدود ۵۷۰۰ سال است، فقط برای بررسی تاریخ اجسامی تا حدود ۶۰۰۰۰ سال قابل اعتماد است. به همین جهت برای تخمین عمر اجسامی با عمر بیشتر از ایزوتوپهای رادیواکتیو دیگری مانند پتاسیم ۴۰ (نیمهعمر ۱٫۳ میلیارد سال)، اورانیوم ۲۳۵ (نیمهعمر ۷۰۴ میلیون سال) یا توریوم ۲۳۲ (نیمهعمر ۱۴ میلیار سال) استفاده میشود.
آیا قرار گرفتن در معرض تشعشعات ایزوتوپ کربن ۱۴ خطرناک است ؟
قرار گرفتن در معرض مقدار زیادی از ایزوتوپ کربن ۱۴ خارجی خطرناک نیست. تشعشعات این ایزوتوپ به سختی از لایه خارجی پوست عبور میکند و خطری برای انسان ایجاد نمیکند.
آلوتروپ های کربن
کربن اتمی عمر کوتاهی دارد به همین جهت کربن در ساختارهای مولکولی متنوع به نام آلوتروپ تثبیت میشود. دگرشکل یا «آلوتروپ» (Allotrope) به حالتهای ساختاری متفاوت برای یک عنصر گفته میشود. کربن قادر است آلوتروپهای متعددی به دلیل ظرفیت شیمیایی خود شکل دهد.
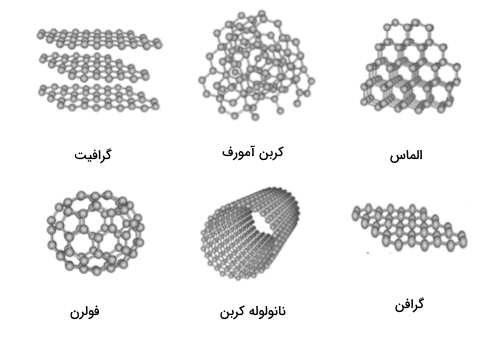
معروفترین این آلوتروپها الماس، گرافیت و «کربن بیشکل» (Amorphous Carbon) هستند. در سالهای اخیر آلوتروپهای دیگری مانند «فولرن باکمینستر» (Buckminsterfullerene) یا توپ باکی، «گرافن» (Graphene)، «نانوتیوب» (Nanotubes)، «نانو روبان» (Nanoribbons) و «نانوجوانه» (Nanobuds) نیز معرفی شدهاند.
آلوتروپهای دیگری نیز برای اتم کربن وجود دارند که در دما یا فشار بالا ایجاد میشوند. بر اساس «پایگاه داده سامارا» (Samara Carbon Allotrope Database | SACADA)، تا به امروز حدود ۵۰۰ آلوتروپ برای کربن شناخته شده است. در ادامه برخی از این آلوتروپها توضیح داده میشوند.
الماس
الماس معروفترین آلوتروپ کربن است. الماس به دلیل سختی، رسانایی گرمایی و ضریب شکست بسیار بالا و همچنین پراکندگی بالای نور کاربردهای زیادی در صنعت و جواهرسازی دارد. الماس سختترین ماده معدنی طبیعی شناخته شده است. هیچ ماده طبیعی شناخته شدهای بجز خودش نمیتواند این آلوتروپ را خراش دهد.
از آنجایی که آرایش اتمها در الماس بسیار سخت است، ناخالصی کمی در آن وجود دارد. تنها بور و نیتروژن میتوانند در ساختار آن وجود داشته باشند. نقصها و ناخالصیهایی که در الماس به وجود میآیند میتوانند رنگ آن را تغییر دهند.
- الماس آبی: به دلیل وجود ناخالصی بور
- الماس زرد: به دلیل وجود ناخالصی نیتروژن
- الماس قهوهای: به دلیل وجود نقص در ساختار
- الماس سبز: به دلیل قرار گرفتن در معرض تابش
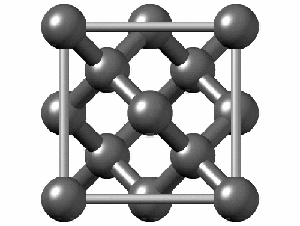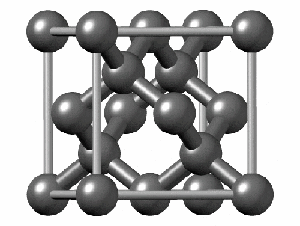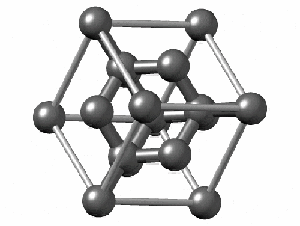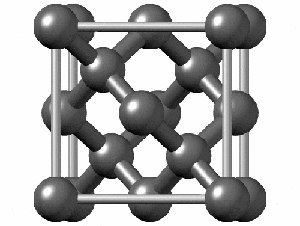
ساختار کریستالی الماس
رایجترین ساختار کریستالی الماس، ساختار مکعبی است. این ساختار از واحدهایی ۸ کربنی متصل به هم تشکیل میشود. هر کربن در الماس با sp³ خود با چهار اتم کربن دیگر پیوند کووالانسی برقرار میکند. همانطور که در شکل زیر مشاهده میکنید اگرچه ۱۸ اتم در شکل وجود دارد، اما هر اتم کربن در گوشه مکعب با هشت واحد و هر اتم در مرکز ضلعهای مکعب با دو واحد مشترک است. به همین دلیل در تصویر زیر ۱۸ اتم کربن وجود دارد.
ویژگیهای فیزیکی الماس
الماس هم در روش اندازهگیری «موس» (Mohs Scale) و هم «ویکرز» (Vickers Scale) سختترین ماده طبیعی است. میزان سختی الماس به خلوص، جهتگیری و کریستالیزه بودن آن ارتباط دارد. الماس ماده سخت و محکمی است چون اتمهای کربن در آن به صورت پیوند کووالانسی به یکدیگر متصل شدهاند و شکستن این پیوندها به نیروی زیادی نیاز دارد. علاوه بر سخت بودن، ویژگی های فیزیکی دیگری نیز در آن وجود دارد که به شرح زیر هستند.
- دمای ذوب بالا
- چگالی نسبی بالا
- اشعه ایکس را عبور میدهد.
- ضریب شکست بالا
- رسانای الکتریکی ضعیف
- رسانای گرمای خوب
- نامحلول در تمامی حلالها
ساخت الماسهای طبیعی و مصنوعی
بیشتر الماسهای طبیعی موجود در روی زمین عمری بین ۱ تا ۳٫۵ میلیارد سال دارند و در عمقی حدود ۱۵۰ تا ۲۵۰ کیلومتر در گوشته زمین ساخته شدهاند. البته تعداد کمی از آنها نیز در عمق ۸۰۰ کیلومتری از سطح زمین ساخته شدهاند. تحت فشار و دمای بالا، مواد ذوب شده حاوی کربن، مواد معدنی مختلف را در خود حل کرده و الماس را جایگزین آنها میکنند. در حدود صدها تا دهها میلیون سال پیش، این الماسها دراثر فوران آتشفشانی به سطح زمین منتقل شدهاند و در سنگهای آذرین معروف به «کیمبرلیت» (Kimberlites) و «لامپرویت» (Lamproites) رسوب کردهاند.
برای تولید الماسهای مصنوعی، کربن با خلوص بالا را تحت فشار و دمای بالا قرار میدهند یا الماسها را از گازهای هیدروکربنی با روش رسوب شیمیایی بخار (Chemical Vapor Deposition | CVD) تولید میکنند. الماس های بدلی را می توان از موادی مانند «زیرکونیا مکعبی» (Cubic Zirconia | CZ) و «سیلیکونکاربید» (Silicon Carbide | SiC) نیز ساخت. الماس های طبیعی و مصنوعی را با استفاده از تکنیکهای نوری یا با اندازهگیری رسانایی گرمایی از یکدیگر تشخیص میدهند.
گرافیت
متداولترین ایزوتوپ کربن، «گرافیت» (Graphite) یا «کیسه سربی» (Plumbago) نام دارد که توسط «ابراهام ورنر» ( Abraham Gottlob Werner) در سال ۱۷۸۹ معرفی شد. این ماده به رنگ طوسی تیره تا مشکی است و مات است. همچنین براساس سیستم موس، سختی برابر با
دارد و بسیار نرم است. برخلاف الماس، گرافیت رسانای الکتریکی است. گرافیت ساختاری ورقهای دارد که از حلقههایی با ۶ اتم کربن ساخته شده است. در واقع در ورقههای گرافیت، اتمهای کربن در شبکه لانه زنبوری با طول پیوند ۰٫۱۴۲ نانومتر قرار میگیرند.
اتمهای کربن در هر ورقه از گرافیت با سه اتم کربن دیگر پیوند کووالانسی برقرار میکنند. از آنجایی که اتمهای کربن گرافیت با sp² هیبرید میشوند، اوربیتالهای p غیرهیبریدی در اتمهای کربن وجود دارند. بنابراین، این اوربیتالهای p آزاد را میتوان با یکدیگر جفت کرد و ابر الکترونی را تشکیل داد. ابر الکترونی به موازات ساختار مسطح گرافیت ایجاد میشود و میتواند هدایت الکتریکی را در گرافیت باعث شود.
ورقههای گرافیت با نیروی ضعیف واندروالسی به یکدیگر متصل میشوند و فاصله بین آنها ۰٫۳۳۵ نانومتر است. در فاصله بین این صفحات معمولا گاز قرار میگیرد که باعث میشود لایههای گرافیت به راحتی از یکدیگر جدا شوند یا روی هم بلغزند. قرارگرفتن لایههای گرافیت روی هم به سه صورت ششوجهی ساده، آلفا و بتا (Rhombohedral) است. در نوع ششوجهی ساده لایهها به صورت –AA– در نوع آلفا لایهها به صورت –ABAB– و در نوع بتا لایهها به صورت –ABCABC– روی یکدیگر قرار میگیرند (تصویر زیر).
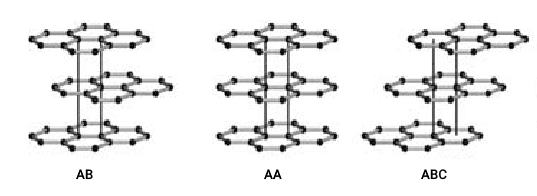
انواع اشکال گرافیت در طبیعت
گرافیت در طبیعت به سه شکل زیر یافت میشود.
- «گرافیت بیشکل» (Amorphous Graphite): گرافیت زمانی تشکیل میشود که مواد دارای کربن برای تشکیل کریستالهای گرافیت مدت زمان کافی را در دمای کافی برای کریستالیزه شدن قرار نگرفته است.
این نوع گرافیت معمولا به صورت ذرات بسیار کوچک و تیره در سنگهای رسوبی مانند زغال سنگ و شیل یافت میشود. از این نوع گرافیت در روان کنندهها، مدادها، باتریها و لنتهای ترمز استفاده میشود. - «گرافیت ورقهای» (Flake Graphite): صفحات مسطحی از گرافیت هستند که در صورت صورت شکسته شدن آنها، لبههای ششضلعی ایجاد میشود. این نوع گرافیت زمانی تشکیل میشود که مواد دارای کربن در معرض دمای بالایی در مدت زمان طولانی قرار بگیرند. گرافیت ورقهای، کربن بیشتری نسبت به گرافیت بیشکل دارد و معمولا به صورت تکهای یا صفحهای تشکیل میشود.
این نوع گرافیت بیشتر از سایر انواع گرافیت در صنعت استفاده میشود و در بسیاری از مواد از جمله از مداد، روانکننده، باتری و پنلهای خورشیدی استفاده میشود. - «گرافیت توده ای» (Vein Graphite): گرافیت تودهای در شکافها یا شکستگیها به صورت تودههای کریستالی فیبریشکل یا سوزنیشکل ایجاد میشود. گرافیت تودهای محتوای کربن بیشتری نسبت به گرافیت بیشکل و ورقهای دارد و مطلوبترین نوع گرافیت است.
در مواد نسوز، سرامیک، روانکننده، باتری و صنعت فولاد استفاده میشود. همچنین به دلیل وجود کربن و رسانایی بالا، مادهای ایدهآل برای استفاده در مصارف الکتریکی است.

ویژگیهای گرافیت
از آنجایی که لایههای گرافیت با پیوند ضعیفی روی هم قرار گرفتهاند، این آلوتروپ میتواند به عنوان روان کننده عمل کند. در صنعت از پودر گرافیت، به عنوان روانکننده خشک به جای روغن استفاده میشود.
همچنین گرافیت دارای درخشندگی فلزی است که به هدایت الکتریسیته کمک میکند. این آلوتروپ رسانای بسیار خوبی برای گرما و الکتریسیته است. تفاوت گرافیت و الماس در جدول زیر نوشته شده است.
| گرافیت | الماس |
| به صورت لایهای است. | به صورت کریستالی است. |
| رسانای جریان الکتریکی است. | عایق الکتریسیته است. |
| ساختار مسطح دارد. | از واحدهای چهاروجهی تشکل شده است. |
| طول پیوند کربن-کربن ۱۴۱٫۵ پیکومتر | طول پیوند کربن-کربن ۱۵۴ پیکومتر |
| رنگ سیاه و کد | شفاف با ضریب شکست بالا (۲٫۴۵) |
| در حلالهای معمول نامحلول است. | در همه حلالها نامحلول است. |
| ساختار نرم و چرب دارد. | بسیار سخت است. |
کربن بیشکل
کربن بیشکل یا «کربن آمورف» (Amorphous Carbon) ساختاری از مولکولهای کربن است که هیچ ساختار کریستالی مانند گرافیت و الماس ندارد. در کانیشناسی به زغالسنگ، کاربید مشتق شده از کربن و هر نوع ساختار کربنی ناخالص را کربن آمورف مینامند.
مانند تمام مواد شیشهای، برخی از نقاط موجود در ساختار کربن آمورف منظم هستند ولی یک الگوی ثابت برای تمام نقاط ساختار کربن آمورف وجود ندارد. کربن آمورف را اغلب به اختصار به صورت «aC»، کربن آمورف هیدروژنه را به صورت «aC:H» و کربن آمورف چهاروجهی (که به آن کربن الماس نیز گفته میشود) را به صورت «ta-C» نشان میدهند.
کاربردهای عنصر کربن
کربن در بسیاری از ساختارهای آلی و معدنی وجود دارد از این رو کاربردهای آن در زندگی روزمره بیشمار است. برخی از آنها در بخش زیر آورده شدهاند.
- کربن، ۱۸٪ از بدن انسان را تشکیل میدهد. قندها، پروتئینها و حتی DNA در ساختار خود اتم کربن دارند.
- کربن به شکل الماس در جواهرسازی استفاده میشود. اما الماسهای مصنوعی به دلیل سختی بالای ساختار خود در صنعت نیز استفاده میشوند. استفاده از الماس در صنعت شامل:
- شیشهبری
- پولیش زدن
- بریدن سایر مواد سخت
- به عنوان سرمته
- کربن بیشکل در تهیه جوهر و رنگ استفاده میشود. همچنین در ساختار برخی از باتریها نیز استفاده میشود.
- گرافیت به دلیل رسانایی الکتریکی بالایی که دارد به عنوان الکترود و همچنین در باتریها استفاده میشود. سایر موارد استفاده از آن به شرح زیر است.
- مغزی مداد: لایههای گرافیت به راحتی از یکدیگر جدا میشوند و بر روی کاغذ به جا میمانند.
- روانکننده
- در نیروگاههای هستهای برای کمک به کاهش سرعت نوترونها در واکنش هستهای
- نسوزهای گرافیتی: زمانی استفاده میشوند که به پوشش کوره غیرمرطوب نیاز باشد. به عنوان مثال تولید آلومینیوم و در کوره های خلا
- تخمین تاریخ اجسام باستانی با استفاده از کربن ۱۴ رادیواکتیو انجام میشود.
- از کربن به شکل ذغال فعال جهت فیلتر هوا و آب استفاده میشود. این نوع ماده کربنی در مسمومیتها نیز به بیماران تجوریز میشود.
ذغال فعال چگونه آب و هوا را تصفیه میکند ؟
ذغال فعال مادهای سیاه، بدون بو و مزه است که از کربن ساخته شده است. ذغال فعال نوعی ذغال چوب است که در دمای بالا تحت واکنش با اکسیژن قرار گرفته تا منافذ ریزی در آن ایجاد شود. ایجاد منافذ ریز سطح بیشتری از این نوع ماده کربنی ایجاد میکند که میتواند ناخالصیها را جذب کند. این ماده در مسمومیتها، سموم را جذب میکند و بدون اینکه جذب بدن شود از بدن خارج میشود.
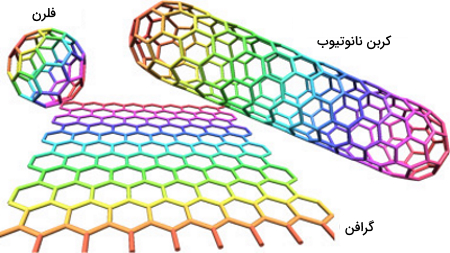
عنصر کربن و نانوتکنولوژی
همانطور که در بخش آلوتروپهای کربن توضیح داده شد، آلوتروپهای جدیدی برای کربن در سالهای اخیر شناسایی شدهاند مانند گرافن، نانولولههای کربنی یا فولرن باکمینستر که در صنعت نانو کاربرد دارند.
- گرافن: یک لایه از اتمهای کربن است که به صورت ششضلعی در کنار یکدیگر قرار گرفتهاند.
- نانولولههای کربنی: لولههایی هستند که از گرافن ساخته شدهاند.
- فولرن باکمینستر: از ۶۰ اتم کربن متصل به هم تشکیل شدهاند که ساختاری کروی با ۲۰ ششضلعی و ۱۲ پنجضلعی ایجاد میکنند.
ترکیبات شیمیایی عنصر کربن
ترکیبات کربنی به ساختارهای شیمیایی گفته می شود که در آنها اتم کربن وجود دارد. بعد از عنصر هیدروژن، ترکیبات کربنی بیش از هر عنصر شیمیایی دیگری وجود دارند. همچنین تعداد ترکیبات کربنی آلی بسیار بیشتر از ترکیبات کربنی معدنی است.
کربن عنصری چهارظرفیتی است با این حال گاهی رادیکالهای آزاد کربن و کاربنها به عنوان مواد حدواسط به وجود میآیند. یونهای کربن کربوکاتیون (بار مثبت) هستند. کربانیون (بار منفی) نیز ممکن است به وجود بیاید ولی در کل عمر کوتاهی دارند. یکی از ویژگیهای مهم کربن توانایی تشکیل زنجیره و حلقههای کربنی طولانی است که به آن «کاتناسیون» (Catenation) میگویند.
کاربیدها
کاربیدها ترکیبات دوتایی از کربن با عنصری دیگر هستند که الکترونگاتیو کمتری نسبت به کربن دارد. مهمترین کاربیدها شامل موارد زیر هستند.
- «آلومینویم کاربید» (Aluminium Carbide) با فرمول شیمیایی
- «برم کاربید» (Boron Carbide) با فرمول شیمیایی
- «کلسیم کاربید» (Calcium Carbide) با فرمول شیمیایی
- «آهن کاربید» (Iron Carbide) یا «سمنتیت» (Cementite) با فرمول شیمیایی
- «هافنیوم کاربید» (Hafnium Carbide) با فرمول شیمیایی
- «سیلیکون کاربید» (Silicon Carbide) با فرمول شیمیایی
- «تنتالوم کاربید» (Tantalum Carbide) با فرمول شیمیایی
- «تیتانیوم کاربید» (Titanium Carbide) با فرمول شیمیایی
- «تنگستن کاربید» (Tungsten Carbide) با فرمول شیمیایی
هالیدهای عنصر کربن
هالیدهای رایج کربن شامل موارد زیر هستند.
- «کربن تترافلورید» (
- )
- «کربن تتراکلرید» (
- )
- «کربن تترابرمید» (
- )
- «کربن تترایدیدن (
- )
ترکیبات آلی عنصر کربن
ابتدا تصور میشد که ترکیبات آلی تنها توسط موجودات زنده ساخته میشوند. اما دانشمندان موفق شدن تعدادی از آنها را نیز در آزمایشگاه تولید کنند. به همین خاطر ترکیبات آلی کربن بیشمارند و تا به امروز حدود ۱۰ میلیون ترکیب آلی کربن شناسایی شده است. در واقع عنصر کربن اساس ترکیبات آلی است. در تعریفی که برای ترکیبات آلی در شیمی ارائه میشود به ترکیبی گفته میشود که یک یا چند اتم کربن به صورت کووالانسی به سایر عنصرها مثل هیدروژن، اکسیژن و نیتروژن متصل شده باشد. ترکیبات زیر مثالهایی از ترکیبات آلی کربن هستند.
- فسژن با فرمول شیمیایی
- تیوفسژن با
- تیوره با فرمول شیمیایی
ترکیبات معدنی عنصر کربن
تنوع زیادی از ترکیبات معدنی کربن وجود دارد. در ادامه مطلب ترکیبات معدنی کربن اکسیژن، کربن نیتروژن و کربن گوگرد توضیح داده میشوند.
ترکیبات کربن اکسیژن
ترکیبات کربن و اکسیژن که اکسید کربنی (اکسوکربن) را ایجاد میکنند بسیار متنوع هستند. مثالهایی از این ترکیبات در بخش زیر نوشته شدهاند.
- دیاکسید کربن (
- )
- مونوکسید کربن (
- )
- کربن سوبوکسید (
- )
- ملیتیک انیدرید (
- )
- دیکربن مونوکسید (
- )
- اگزالیک انیدرید (
- )
- کربن تریاکسید (
- )
آنیون اکسوکربن نیز نوعی دیگر از ترکیبات معدنی کربن اکسیژن هستند که به صورت یونهای منفی وجود دارند. معروف ترین آنیون اکسوکربن، «کربنات» (
) و «اگزالات» () هستند که میتوانند اسیدهای کربنیکاسید ناپایدار و اگزالیکاسید پایدار را تشکیل دهند.این آنیونها را میتوان دپوروتونه کرد تا بیکربنات () و هیدروژن اگزالات (
) به دست آورد.
آنیونهای کربن اکسیژن دیگری نیز وجود دارد که ساختاری عجیب دارند. مثالی از این آنیونها شامل «استیلن دیکربوکسیلات» (O_2C–C≡C–CO_2^{2-})، «ملیتات» (
) و «اسکوارات» (
) هستند.
ترکیبات کربن گوگرد
ترکیبات کربن گوگرد معدنی مهم شامل «کربندیسولفید» (
) و «کربونیلسولفید» () هستند. ترکیب «کربنمنوسولفید» (
) برخلاف کربنمنوکسید بسیار ناپایدار است. کلاسهای مهم ترکیبات کربن گوگرد شامل موارد زیر میشود.
- «تیوکربوناتها» (Thiocarbonates)
- «تیوکارباماتها» (Thiocarbamates)
- «دیتیوکارباماتها» (Dithiocarbamates)
- «تریتیوکربناتها» (Trithiocarbonates)
ترکیبات کربن نیتروژن
ترکیبات کوچک و معدنی کربن نیتروژن شامل موارد زیر هستند.
- «سیانوژن» (Cyanogen) با ساختار
- در اثر پلیمریزه شدن سیانوژن، «پاراسیانوژن» (Paracyanogen) به وجود میآید.
- «هیدروژن سیانید» (Hydrogen Cyanide) با ساختار
- «سیانامید» (Cyanamide) با ساختار
- «ایزوسیانیک اسید» (Isocyanic Acid) با ساختار
- «سیانوژن کلراید» (Cyanogen Chloride) با ساختار
- «سیانوریککلرید» (Cyanuric Chloride) تریمر سیانوژن کلرید است.
- «کلروسولفونیل ایزوسیانات» (Chlorosulfonyl Isocyanate) با ساختار
- «سیانوریک کلرید» (Cyanuric Chloride) با ساختار
چرخه عنصر کربن
چرخه کربن چرخهای «زیستژئوشیمی» (Biogeochemical) است که در آن کربن میان «زیستکره» (Biosphere)، «خاککره» (Geosphere)، «خاکسپهر» (Pedosphere)، «آبکره» (Hydrosphere)، اتمسفر زمین جابجا میشود. چرخه کربن در کنار چرخه آب و نیتروژن، شرایطی را فراهم میکنند که حیات بر روی زمین باقی بماند.
چرخه کربن اولین بار توسط «آنتوان لاووازیه» (Antoine Lavoisier) و «جوزف پریستلی» (Joseph Priestley) توضیح داده شد و توسط «هامفری دیوی» (Humphry Davy) معروف شد. بعد از انقلاب صنعتی و به خصوص پس از جنگ جهانی دوم، فعالیتهای انسانها و اضافه کردن میزان زیادی از کربن به جو زمین چرخه کربن جهانی را بهم زد و گرمایش جهانی را ایجاد کرد. چرخه کربن به دو نوع دراز مدت یا کند و کوتاهمدت یا سریع تقسیم میشود.
چرخه کند عنصر کربن
بین ۱۰۰ تا ۲۰۰ میلیون سال طول میکشد تا کربن بین سنگها، خاک، اقیانوسها و اتمسفر در گردش باشد. به طور متوسط،
تا
گرم کربن در هر سال در چرخه کربن آهسته حرکت میکند. حرکت کربن از اتمسفر به «لیتوسفر» (Lithosphere) با بارش باران آغاز میشود. کربن موجود در اتمسفر با آب ترکیب میشود و اسید ضعیفی به نام کربنیک اسید تولید میکند. کربنیک اسید به روی زمین میآید و یون کلسیم، منیزیم،پتاسیم یا سدیم را از سنگهای موجود در زیمن آزاد میکند و با خود از طریق رودختنهها به اقیانوس میریزد.
در اقیانوس، یون کلسیم با بیکربنات ترکیب میشود و کلسیم کربنات (گچ موجود در آبهای سخت) را ایجاد میکند. در اقیانوسهای مدرن، بیشتر کلسیم کربنات توسط موجودات پوستهساز (مانند مرجانها) و پلانکتونها ساخته میشود. پس از مرگ این موجودات، به کف دریا رسوب میکنند. با گذشت زمان، لایههایی از پوسته و رسوب به هم میچسبند و به سنگ تبدیل میشوند و به این صورت کربن را در سنگ ذخیره میکنند.
تنها ۸۰٪ از سنگهای حاوی کربن از این طریق ساخته شدهاند و ۲۰٪ باقیمانده از موجودات زنده (کربن آلی) ایجاد شدهاند. این موجودات زنده در لایهای از گلولای قرار گرفتهاند و تحت تاثیر دما و فشار طی چندین میلیون سال سنگهای رسوبی حاوی کربن را تشکیل دادهاند. در برخی موارد سرعت تجزیه موجودات مرده کمتر از تولید آن است و به جای تشکیل سنگهای رسوبی، موادی مانند نفت، گاز و ذغالسنگ تولید میشود.
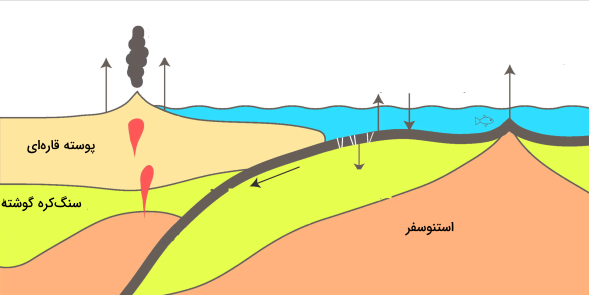
چرخه کند کربن، این عنصر را از طریق آتشفشانها دوباره به اتمسفر باز میگرداند. سطح زمین و اقیانوس روی چندین صفحه پوسته متحرک قرار دارند. هنگامی که صفحات با هم برخورد میکنند، یکی در زیر دیگری فرو می رود و سنگی که حمل میکند تحت فشار و گرمای شدید ذوب میشود. سنگ ذوب شده دوباره به مواد معدنی سیلیکات تبدیل میشود و کربن را به صورت
آزاد میکند.
هنگامی که آتشفشانها فوران میکنند، گازهایی حاوی کربن به اتمسفر وارد میکنند و زمین را با سنگهای سیلیکات تازه میپوشانند تا چرخه کربن دوباره شروع شود. در حال حاضر، آتشفشانها بین ۱۳۰ تا ۳۸۰ میلیون تن
در سال آزاد میکنند. این درحالی است که انسانها با سوزاندن سوختهای فسیلی حدود ۳۰ میلیارد تن
در سال منتشر می کنند (۱۰۰ تا ۳۰۰ برابر بیشتر از آتشفشانها).
چرخه سریع عنصر کربن
چرخه سریع کربن در اثر حرکت کربن از طریق موجودات زنده روی زمین یا «بیوسفر» (Biosphere) است. هر سال بین
تا
گرم کربن در چرخه کربن سریع حرکت میکند.
بسیاری از مولکولهای آلی حاوی اتمهای کربنی هستند که پیوندهای محکمی با دیگر اتمهای کربن ایجاد کردهاند و به صورت زنجیره و حلقه وجود دارند. این زنجیرهها و حلقههای کربنی اساس سلولهای زنده هستند. پیوندهای موجود در زنجیرههای کربنی طولانی دارای انرژی بالایی هستند. به همین جهت وقتی زنجیرهها از هم جدا میشوند، انرژی ذخیره شده زیادی آزاد میشود. این انرژی مولکولهای کربن را به منبع عالی سوخت برای همه موجودات زنده تبدیل کرده است.
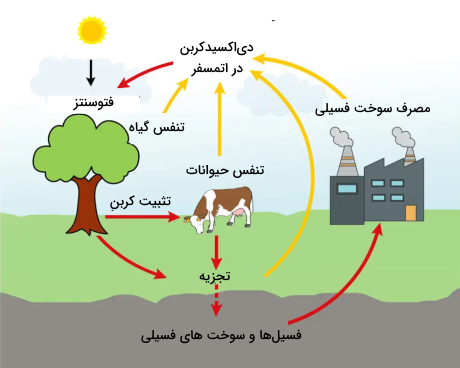
گیاهان و فیتوپلانکتونها اجزای اصلی چرخه سریع کربن هستند. فیتوپلانکتون (موجودات میکروسکوپی موجود در اقیانوسها) و گیاهان با جذب
در اتمسفر، آنها را وارد سلولهای خود میکنند. سپس با استفاده از انرژی خورشید، هم گیاهان و هم پلانکتونها و اکسیژن را با هم ترکیب میکنند تا قند (
) و اکسیژن تولید کنند. واکنش شیمیایی آن به صورت زیر است.
فتوسنتز کنندهها از این قندها برای متابولیسم خود استفاده میکنند و مازاد آن را به صورت چربی و پلیساکارید ذخیره میکنند. مواد ذخیره شده توسط موجودات دیگر (از تک یاختهها گرفته تا انسان) مصرف میشوند و این موجودات آنها را به اشکال دیگری از کربن تبدیل میکنند.
دیاکسید کربن آزاد شده در واکنش معمولا به اتمسفر انتقال مییابد. چرخه سریع کربن به مقدار زیادی به زندگی گیاهان مرتبط است به طوری که در فصل رشد گیاهان در اتمسفر نوسان دیاکسید کربن مشاهده میشود.
توسط حیوانات و برخی موجودات دیگر به عنوان محصول جانبی تنفس به اتمسفر اضافه میشود. کربن موجود در فضولات حیوانی و بدن موجودات توسط ارگانیسمهای تجزیهکننده (باکتریها و قارچها) به صورت
در اثر تغییرات میکروبی آزاد میشود.
جمعبندی
عنصر کربن با نماد شیمیایی C و عدد اتمی ۶ در گروه ۱۴ جدول تناوبی قرار گرفته است. این عنصر در بسیاری از ساختارهای آلی و معدنی وجود دارد. ۱۵ ایزوتوپ کربن شناخته شده است که نوع کربن ۱۲ پایدارترین آن است. از ایزوتوپ طبیعی کربن ۱۴ به دلیل خواص رادیواکتیو و نیمهعمر بالا برای تعیین قدمت اجسام استفاده میکنند. الماس، گرافیت و کربن آمورف معروفترین آلوتروپهای کربن هستند که کاربردهای زیادی در صنعت دارند. کربن برای حیات موجودات در زمین اهمیت ویژهای دارد و همواره در چرخه کربن بین اتمسفر، آبها و زمین جابجا میشود.





