آب سنگین یا دوتریم دیاکسید یا آب دوتره آبی است که به جای دو اتم هیدروژن ، ایزوتوپ سنگینتر آن یعنی دوتریم را در ساختار خود دارد. وجود اتم هیدروژن به صورت ایزوتوپ سنگینتر یعنی دوتریم، باعث تغییر در ساختار آب میشود. همچنین آب سنگین در برخی ویژگیهای شیمیایی و فیزیکی نیز با آب معمولی متفاوت است. در این مطلب میخواهیم بدانیم آب سنگین چیست، چگونه تولید میشود و چه کاربردهایی دارد.
آب سنگین چیست ؟
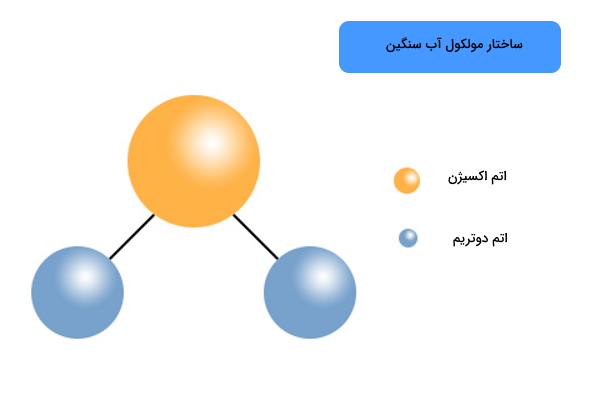
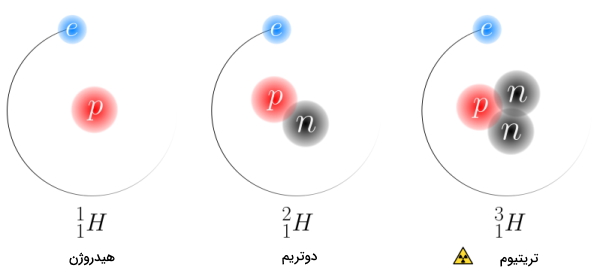
آب سنگین (Heavy Water) آبی است که در ساختار خود به جای دو اتم هیدروژن خود، دو عدد دوتریم دارد. همانطور که میدانید دوتریم ایزوتوپ سنگین هیدروژن است، به همین دلیل به این ساختار آب سنگین میگویند. تفاوت هیدروژن و ودوتریم در ساختار هسته آنهاست بهطوری که هر کدام دو عدد پرتون دارند اما در تعداد نوترون با یکدیگر متفاوت هستند.
در جدول زیر تفاوت سه ایزوتوپ متفاوت عنصر هیدروژن (هیدروژن، دوتریم و تریتیوم) را مشاهده میکنید.
| ایزوتوپ | تعداد پروتون | تعداد نوترون |
| هیدروژن |
| ۱ | ۰ | |
| دوتریم |
| ۱ | ۱ | |
| تریتیوم |
| ۱ | ۲ |
از آنجا که دوتریم دوبرابر هیدروژن نوترون دارد، جرم آن نیز دو برابر خواهد شد. در حالت عادی در ساختار آب طبیعی، به ازای هر یک میلیون اتم هیدروژن تنها ۱۵۶ عدد اتم دوتریم وجود دارد. طبق منابع، به آبی که به نسبت این عدد عادی دوتریم بیشتری داشته باشد نیز آب سنگین میگویند. یعنی چیزی بیش از ۰٫۰۱۵۶ اتم هیدروژن باید با دوتریم جایگزین شده باشد. بهطور کلی ترکیبهایی به صورت
، ،
که در آنها دوتریم نسبت به هیدروژن درصد بیشتری داشته باشد، آب سنگین است.
برای روشن شدن موضوع مثالی را در این مورد بررسی میکنیم. راکتور معروف کاندو در کشور کانادا، حاوی آب غنی شده با دوتریم به صورت
است اما در آن مقداری آب به صورت نیز وجود دارد. همچنین مقادیر بسیار جزئی از
نیز در آن یافت میشود. راکتو کاندو ۹۹٫۷۵٪ غنی شده است، یعنی ۹۹٫۷۵٪ هیدروژن موجود در ساختار آب آن به فرم دوتریم یافت میشود.
با این حال نکتهای که وجود دارد این است که جرم آب سنگین تفاوت بسیار اندکی با آب معمولی دارد. زیرا بیشتر جرم مولکول آب، یعنی ۸۹% آن از اکسیژن است که در ساختار آب سنگین، دستنخورده باقی میماند. در لیست زیر به تعدادی از مهمترین ویژگیهای آب سنگین بهطور خلاصه اشاره میکنیم. در ادامه در بخشی جداگانه در مورد مهمترین این ویژگیها صحبت خواهیم کرد.
- هسته اتم دوتریم حاوی یک عدد نوترون و یک عدد پروتون است که این باعث میشود نسبت به هیدروژن جرم بیشتری داشته باشد. همانطور که میدانید هسته اتم هیدروژن تنها یک عدد پروتون دارد و فاقد نوترون است.
- چگالی آب سنگین ۱۱٪ بیشتر از آب معمولی است.
- پیوند بین دوتریم و اکسیژن در آب سنگین قویتر از پیوند بین هیدروژن و اکسیژن در آب معمولی است.
- آب سنگین رادیواکتیو نیست. تنها تفاوت آب معمولی و آب سنگین جایگزین شدن اتم هیدروژن با ایزوتوپ آن یعنی دوتریم است و از آنجا که دوتریم رادیواکتیو نیست، آب سنگین نیز مانند آب معمولی از خود تابشی ساطع نمیکند.
- مقدار زیاد آب سنگین برای برخی سیستمهای زیستی مخرب و سمی است.
- تقریبا ۸۹٪ جرم مولکولی آب، مربوط به عنصر اکسیژن است. به همین دلیل تفاوت جرم مولکولی فاحشی بین آب معمولی و آب سنگین وجود ندارد.
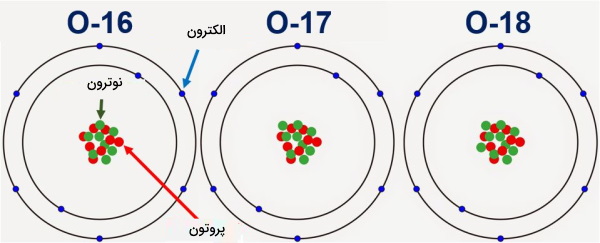
آب سنگین اکسیژنی چیست ؟
حال که متوجه شدیم آب سنگین چیست میخواهیم بدانیم که چند مدل آب سنگین و با چه مشخصاتی وجود دارند. آب سنگین به نحوه دیگری نیز میتواند وجود داشته باشد. آبی که در آن اتم اکسیژن معمولی با ایزوتوپهای
و جایگزین شده باشد نیز آب سنگین است. این آب، از آنجا که حاوی دوتریم نیست در اکثر موارد به نام آب سنگین خوانده نمیشود، زیرا این دوتریم است که به آب سنگین ویژگیهای منحصربهفرد هستهای و زیستی میدهد. آب سنگین اکسیژنی نامی است که به آب حاوی ایزوتوپ سنگین اکسیژن میگویند. جرم مولکول تقریبا برابر با جرم است. همچنین جرمی بین و
دارد.
این آب بهمراتب از آب سنگین گرانتر است زیرا جداسازی
و دشوارتر است. آب سنگین اکسیژنی نسبت به آب سنگین هیدروژنی تغییرات کمتری را در ویژگیهای فیزیکی خود متحمل میشود. مقادیر بسیار کمی اتم و
در آب طبیعی وجود دارد و در فرایند غنیسازی آب سنگین نیز ناخواسته به وجود میآیند.
کاربرد آب سنگین اکسیژنی
از این آب برای تولید رادیو داروی فلوئور-۱۸ که در اسکن توموگرافی انتشار پوزیترون (Positron Emission Tomography) نیز کاربرد دارد، استفاده میشود. حضور اتم اکسیژن به صورت
زمانی که آب سنگین در راکتور هستهای به عنوان تعدیلکننده نوترون (Neutron Moderator) به کار میرود، نامطلوب است زیرا میتواند نوترون را به دام بیاندازد و با تابش یک ذره آلفا، اتم رادیواکتیو
را تولید کند. آبی که هر دو اتم اکسیژن و هیدروژن آن با ایزوتوپهای خود جایگزین شده باشند به عنوان ردیاب ایزوتوپی غیر رادیواکتیو کاربرد دارد.
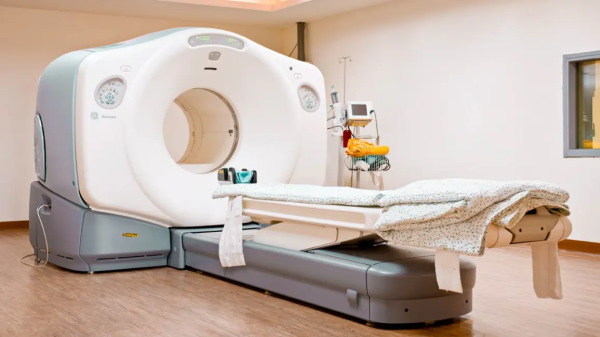
آب سنگین تریتیله چیست ؟
آب سنگین میتواند از جایگزینی اتم هیدروژن با ایزوتوپ
یا همان
نیز به وجود بیاید. از آنجا که خود اتم تریتیوم رادیواکتیو است، آب بهدست آمده از این روش جایگزینی، نیز رادیواکتیو خواهد بود.
در زیر به برخی از مهمترین ویژگیهای این نوع آب میپردازیم.
- این آب را به صورت
- نمایش میدهند و معمولا به آن آب فوق سنگین گفته میشود.
- جرم مولی آب فوق سنگین ۲۲٫۰۳ گرم بر مول است.
- از آب فوق سنگین برای اندازهگیری حجم کل آب موجود در بدن انسان کمک گرفته میشود.
- چگالی آب فوق سنگین ۱٫۸۵ گرم بر مول است.
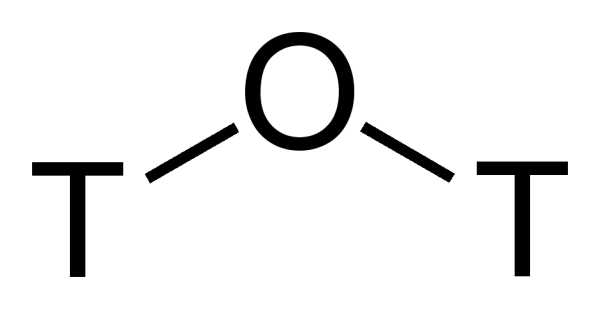
آب نیمه سنگین چیست ؟
آب نیمه سنگین (Semiheavy Water) که به صورت
نشان داده میشود حالتی است که مولکولهای آب به هر دو صورت و در ترکیب با یکدیگر حضور داشته باشند. در این حالت اتمهای دوتریم و هیدروژن بهطور متناوب بین مولکولهای آب در حال تعویض با یکدیگر هستند. به عبارتی اگر آبی در ساختار خود ۵۰% هیدروژن و ۵۰٪ دوتریم داشته باشد در واقع شامل ۵۰٪ است و باقی آن ۲۵٪ شامل و ۲۵٪
در تعادلی دینامیک، خواهد بود.
در آب معمولی از هر ۳۲۰۰ مولکول، ۱ مولکول به صورت HDO وجود دارد، یعنی به ازای هر ۶۴۰۰ اتم هیدروژن یک اتم دوتریم داریم. همین در مورد
این نسبت بهصورت ۱ به ۴۱ میلیون مولکول است. از این مقایسه میتوان اینطور نتیجهگیری کرد که وجود مولکولهای آب نیمهسنگین بسیار محتملتر از آب سنگین بهصورت خالص است. آب نیمهسنگین بسیار ناپایدار است اما اگر در فاز گازی تولید شود و سپس فوری به صورت جامد در بیاید، یخ پایداری خواهد داشت.
ویژگی آب سنگین
آب سنگین از خود خاصیت رادیواکتیوی نشان نمیدهد و در فرم خالص خود نسبت به آب معمولی ۱۱٪ چگالی بیشتری دارد. آب معمولی و آب سنگین نسبت به دیگر مولکولها در زمان جایگزینی یک اتم با ایزوتوپش، تفاوتهای وسیعی دارند. زیرا همانطور که گفتیم دوتریم دوبرابر هیدروژن جرم دارد و هیچ دو ایزوتوپ دیگری چنین ویژگی ندارند. این تفاوتها بهخصوص در موارد زیستی خود را نشان میدهند. این تفاوت جرم باعث میشود انرژی پیوند بین اکسیژن و هیدروژن در آب سنگین نسبت به آب عادی بیشتر باشد. این ویژگی برای ایجاد تفاوت در واکنشهای بیوشیمیایی که آب را در خود درگیر میکنند، کافی است.
ویژگی های فیزیکی آب سنگین
در جدول زیر برخی از مهمترین ویژگیهای فیزیکی آب معمولی، سنگین و نیمهسنگین را با یکدیگر مقایسه میکنیم.
| ویژگی | آب سنگین |
| آب نیمهسنگین |
| آب سبک |
| نقطه ذوب (سانتیگراد) | ۳٫۸۲ | ۲٫۰۴ | ۰ |
| نقطه جوش (سانتیگراد) | ۱۰۱٫۴ | ۱۰۰٫۷ | ۱۰۰ |
| چگالی (گرم/ میلیلیتر) | ۱٫۱۰۵۶ | ۱٫۰۵۴ | ۰٫۹۹۸۲ |
| ضریب بازتاب | ۱٫۳۲۸ | نامشخص | ۱٫۳۳۳ |
| ۷٫۴۴ | ۷٫۲۶۶ | ۷٫۰ | |
| گرمای تبخیر (کیلوژول/ مول) | ۴۱٫۵۲۱ | نامشخص | ۴۰٫۶۵۷ |
| گرانروی دینامیکی (میلیپاسکال/ ثانیه) | ۱٫۲۴۶۷ | ۱٫۱۲۴۸ | ۱٫۰۰۱۶ |
| فشار سطح (نیوتون/ متر) | ۰٫۰۷۱۸۷ | ۰٫۰۷۱۹۳ | ۰٫۰۷۱۹۸ |
| گرمای ذوب (کیلوژول/ مول) | ۶٫۱۳۲ | ۶٫۲۲۷ | ۶٫۰۰۶۷ |
همانطور که مشاهده میکنید ویژگیهای فیزیکی آب معمولی و آب سنگین با یکدیگر تفاوتهای زیادی دارند. تفکیک آب سنگین نسبت به آب معمولی در دمای مشخص کمتر صورت میگیرد و در نتیجه غلظت یون
نیز نسبت به یون ، کمتر خواهد بود. همین مورد را میتوان به آنیونهای حاصل از تفکیک آب یعنی و
نیز تعمیم داد. آب سنگین و آب معمولی در صورت مخلوط شدن، مایعی هموژن به دست میدهند.
چگالی آب سنگین ۱۰٫۶٪ بیشتر از آب معمولی است و این را میتوان با انداختن تکهای یخ حاصل از آب سنگین در لیوانی از آب معمولی به چشم دید. در این حالت به جای اینکه یخ روی آب شناور بماند به ته ظرف میرود.

طعم آب سنگین
در این بخش میخواهیم بدانیم آیا تنها با نوشیدن آب میتوان متوجه شد که آب سنگین است یا معمولی؟ مطالعهای در سال ۱۹۳۵ در همین راستا انجام شد که طبق آن کوچکترین تفاوت طعمی بین آب سنگین و آب معمولی وجود نداشت. سالهای بعد تحقیق دیگری گزارش کرد که آب سنگین کمی شیرینتر از آب معمولی است. آزمایش دیگری که روی موشهای آزمایشگاهی صورت گرفت، نشان داد که در صورت داشتن حق انتخاب، موشها از خوردن آب سنگین اجتناب میکنند. این میتواند هم به بو و هم طعم آب ربط داشته باشد.

رنگ آب سنگین
آب در حالت معمولی و در مقدار کم بیرنگ است با این حال با توجه به رنگی که از مقادیر زیاد آب مثلا در دریا و اقیانوس مشاهده میشود، رنگ آبی نیز از آن دیده میشود.

آب سنگین حتی در مقادیر زیاد نیز بیرنگ است و این تفاوت به این دلیل است که در آب سبک ارتعاشات مولکولی با یکدیگر همساز هستند. این باعث جذب قست قرمز طیف مرئی میشود. در آب سنگین این ارتعاشات به قسمت مادون قرمز منتقل میشود، بنابراین هیچ جذب نور قرمزی ندارند.
ویژگی های شیمیایی آب سنگین
آب معمولی و آب سنگین به دلیل جایگزینی ایزوتوپ سنگین هیدروژن با دوتریم از خود ویژگیهای شیمیایی متفاوتی نشان میدهد. در این بخش به برخی از مهمترین این ویژگیها میپردازیم.
- آب معمولی و آب سنگین به دلیل اختلاف جرم بین هیدروژن و دوتریم ( جرم هر اتم دوتریم دو برابر اتم هیدروژن است) جرم اتمی متفاوتی دارند.
- آب سنگین زمانی که به عنوان حلال به کار گرفته میشود، رفتار متفاوتی نسبت به آب معمولی خواهد داشت.
- آب سنگین و آب معمولی در برخورد با سیستمهای زیستی متفاوت عمل خواهند کرد.
- تفکیک آب سنگین به نسبت آب معمولی کمتر است.
- در دمای مشخص، غلطت یون
در نمونه آب سنگین کمتر از غلظت یون
- در نمونه آب معمولی خواهد بود.
واکنش های آب سنگین
در این قسمت به برخی از مهمترین واکنشهای شیمیایی که آب سنگین را به خود درگیر میکنند، میپردازیم. این نکته را در نظر داشته باشیم که آب سنگین نسبت به آب معمولی با سرعت پایینتری وارد واکنشهای شیمیایی میشود.
- الکترولیز: با الکترولیز آب سنگین، ایزوتوپ دوتریم در کاتد به دست میآید.
- واکنش با قلیا و فلزهای قلیایی: طی این واکنش دیدوتریم
- تولید میشود اما واکنش بسیار آهسته پیش میرود.
- واکنش با اکسیدهای فلزی: این واکنش نیز بسیار آهسته است و دوتروکسید فلز مربوطه را تولید میکند.
- واکنش با اکسیدهای نافلزی: در این واکنش اسیدهای دوتره نافلز مربوطه تولید میشود. اکسیدهای نافلزی مانند فسفر پنتااکسید
و گوگرد تریاکسید
- به سرعت در آب سنگین حل میشوند.
- واکنش با نیترید، فسفید و آرسنید فلزها: زمانی که آب سنگین با نیترید
، فسفید و آرسنید فلزها وارد واکنش میشود به ترتیب، دوترو آمونیاک ، دوترو فسفین و دوترو آرسین
- آزاد میشود.
- تشکیل دوترات: به هیدراتهای سنگین حاصل از واکنش با آب سنگین، دوترات میگویند.
- واکنش جابهجایی: زمانی که مولکولی در آب سنگین حل میشود، تعدادی از اتمها آن یا حتی تمام آنها با دوتریم جایگزین شده و اصطلاحا مولکول دوتره میشود.
مثال واکنش آب سنگین
در ادامه مثالهایی از هر کدام از واکنشهای بالا آورده شده است.
- واکنش اول: در این واکنش آب سنگین به اجزای سازنده خود یعنی دوتریم و اکسیژن تفکیک میشود.
- واکنش دوم: در این واکنش دوتروکسید فلزی (هیدروکسیدی که در آن ایزوتوپ دوتریم جایگزین هیدروژن شده باشد) تشکیل میشود.
- واکنش سوم: این واکنش نیز مانند واکنش قبل منجر به تشکیل دوتروکسید اما از نوع نافلزی میشود.
- واکنش چهارم: واکنش بین منیزیم اکسید
و آب دوتره به تشکیل منیزیم دوتروکسید
- میانجامد.
- واکنش پنجم: سولفات
با آب سنگین وارد واکنش میشود و سولفوریک اسید دوتره
- به دست میآید.
- واکنش ششم: نتیجه واکنش بین منیزیم نیترید
و آب سنگین، آمونیاک دوتره و منیزیم دوترکسید
- است.
- واکنش هفتم: در این واکنش کلسیم فسفید
با آب سنگین ترکیب میشوند و دو محصول کلسیم دوتروکسید و فسفید دوتره
- را به وجود میآورند.
- واکنش هشتم: بین دو ماده کلسیم کاربید
و آب سنگین واکنش صورت میگیرد و دو محصول استیلن دوتره و کلسیم دوتروکسید
- به وجود میآیند.
- واکنش نهم: واکنش بین آلومینیوم کاربید
و آب سنگین منجر به تشکیل آلومینیوم دوتروکسید و متان دوتره
- میشود.
تولید آب سنگین
در طبیعت به ازای هر ۳۲۰۰ مولکول آب، ۱ مولکول آب نیمهسنگین وجود دارد و با توجه به اینکه هر مولکول آب دو اتم هیدروژن دارد، به ازای هر ۶۴۰۰ اتم هیدروژن، ۱ اتم دوتریم داریم. مولکول آب نیمه سنگین با فرمول
را میتوان با روشهای متنوعی از جمله تقطیر، الکترولیز و برخی روشهای شیمیایی که همه از اثر سینتیکی ایزوتوپ بهره میبرند، از آب معمولی جدا کرد. دوتریم مورد نیاز برای آب سنگین را میتوان در راکتور هستهای تولید کرد اما همچنان مقرون بهصرفهترین روش برای داشتن دوتریم جدا کردن آن از آب معمولی است.
تفاوت موجود در جرم اتمی دو ایزوتوپ هیدروژن و دوتریم باعث میشود که در مقدار انرژی نقطه صفر نیز با یکدیگر اختلاف داشته باشند. بنابراین این دو ایزوتوپ با سرعت متفاوتی وارد واکنشهای شیمیایی میشوند.
زمانی که میزان مولکولهای
در آب معمولی افزایش پیدا کند، به دلیل تبادل هیدروژن بین مولکولهای آب، مقدار آب سنگین نیز بیشتر میشود. استفاده از دو روش تقطیر و الکترولیز نیازمند انجام هر کدام به صورت آبشاری است و این مصرف انرژی را به مقدار بسیار زیادی بالا میبرد. بنابراین ترجیح بر استفاده از روشهای شیمیایی است.

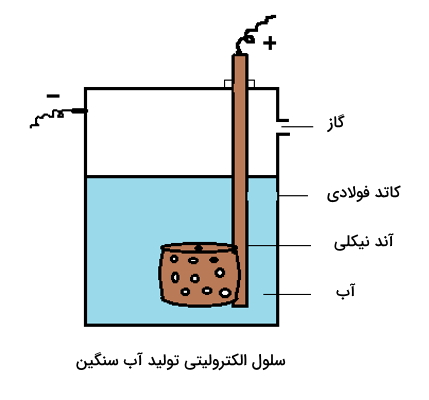
روش الکترولیز
آب سنگین را میتوان از الکترولیز (Electrolysis) طولانی مدت آب حاوی فلزهای قلیایی به دست آورد. اجزای مورد نیاز برای انجام این واکنش به شرح زیر است.
- الکترولیت: آب معمولی حای سدیم هیدروکسید
- کاتد: مفتول فولادی
- آند: ورقه نیکل حفرهدار
این فرایند الکترولیز به کمک عبور گاز کربن دی اکسید
خنثی میشود و در پایان واکنش، آب سنگین به دست میآید.
مبنای استفاده از الکترولیز برای تولید آب سنگین چیست ؟
در روش الکترولیز با استفاده از جریان الکتریکی آب را به عنصرهای سازنده آن تفکیک میکنند. این تکنیک بر این اصل تکیه دارد که آب معمولی سریعتر از آب سبک تفکیک میشود. بنابراین با پیشرفت الکترولیز از میزان آب معمولی کم شده و آب باقی مانده غنیتر خواهد بود. با تکرار چندین باره این واکنش در نهایت آب سنگین خالص به دست میآید. با این حال این روش زمانگیر و گران قیمت است.
شرکت نورسک هیدروی نروژ از سلولهای الکترولیتی برای تولید آب سنگین در مقیاس صنعتی استفاده میکند. در سال ۱۹۳۵، دانشمندان سرتاسر اروپا در زمینههای شیمی، فیزیک و پزشکی از تولیدات این شرکت برای تحقیقات خود بهره میبردند.
کاربرد آب سنگین
از آب سنگین در بسیاری صنایع و برای کاربردهای متنوعی استفاده میشود. در زیر لیستی از مهمترین این موراد استفاده را مشاهده میکنید و سپس در بخش بعد تعدادی از این کاربردها را بهطور کامل توضیح میدهیم.
- از آب سنگین برای مطالعه روند فتوسنتز گیاهان استفاده میشود.
- از آب سنگین برای آمادهسازی دوتریم کمک گرفته میشود.
- حلال آب سنگین در طیفسنجی رزونانس مغناطیس هستهای کاربرد دارد.
- ایزوتوپولوگ (Isotopologue) بسیاری ترکیبات آلی به کمک دوتریم دیاکسید آماده میشوند.
- در طیفسنجی مادون قرمز (Infrared Spectroscopy)، به جای آب معمولی از آب سنگین استفاده میشود.
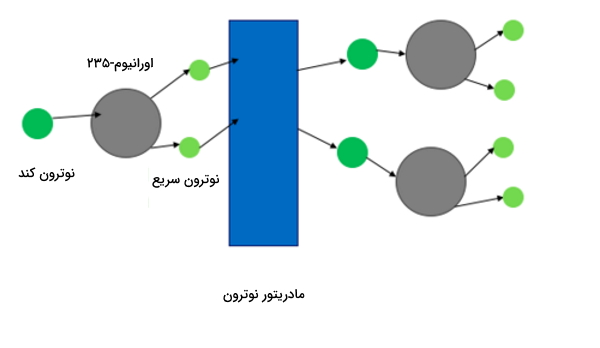
- آب سنگین در راکتورهای هستهای به عنوان تعدیلکننده نوترون به کار گرفته میشود. وظیفه آب سنگین در راکتور کند کردن حرکت نوترون است بهصورتی که توانایی و زمان لازم برای وارد واکنش شدن با اورانیوم-۲۳۵ را داشته باشد. در عدم حضور آب سنگین، نوترون با ایزوتوپ اورانیوم-۲۳۸ وارد واکنش میشود.
- سرعت متابولیسم در بدن انسان با استفاده از مخلوط آب سنگین هیدروژنی و آب سنگین اکسیژنی مورد مطالعه قرار میگیرد.
- زمانی که دوتریم موجود در آب سنگین، نوترونی را به دام میاندازد تبدیل به تریتیوم میشود. از این تریتیوم برای کنترل واکنشهای شکافت هستهای استفاده میشود.
طیف سنجی رزونانس مغناطیس هسته ای
حلال مورد استفاده در طیفسنجی روزنانسی مغناطیس هستهای هیدروژن (Hydrogen-1 Nuclear Magnetic Resonance)، دوتریم اکسید است. اگر از آب معمولی استفاده شود، سیگنال هیدروژن حلال با سیگنال هیدروژنهای مولکول مورد مطالعه اشتباه گرفته میشود و قابل تشخیص نخواهد بود. دوتریم دارای ممان مغناطیسی متفاوتی است و از خود سیگنالی در فرکانس رزونانس هیدروژن
نشان نمیدهد.
مورد دیگر کاربرد آب سنگین در طیفسنجی رزونانس مغناطیس هستهای شناسایی هیدروژنهای ناپایدار برخی ترکیبها است. اینها هیدروژنهایی هستند که به راحتی تبدیل به
میشوند. با افزودن آب سنگین، این اتمهای پایدار جدا شده و با اتمهای دوتریم جایگزین میشوند، بنابراین در طیف دارای سیگنالی نمیباشند. به این طریق میتوان با استفاده از حلال دوتریم اکسید به وجود هیدروژنهای ناپایدار پی برد.
شیمی آلی
از دوتریم اکسید اغلب به عنوان منبع دوتریم برای برچسب زدن (Labelling) به ایزوتوپولوگهای ترکیبهای آلی استفاده میشود. برای مثال پیوند
مجاور گروه عاملی کربونیل کتونی را میتوان به کمک کاتالیزور اسیدی یا بازی، با پیوند
جایگزین کرد. باید به این نکته توجه داشت که منابع آب سنگین ممکن است حاوی تریتیوم نیز باشند و در جایی که تفاوت بین برچسب خوردن با دوتریم و تریتیم مهم است، باید به این نکته توجه کرد. در ادامه مثالی از این مورد را بررسی خواهیم کرد.
تریمتیل سولفونوکسیم یدید
حاصل از واکنش بین دیمتیل سولفوکسید و متیل یدید
را میتوان در دوتریم اکسید حل کرد و بلور مجدد آن را به دست آورد و با تفکیک دوباره این محصول بلوری، دیمتیل سولفوکسید و متیل یدید برچسبخورده با دوتریم را به دست آورد.
طیف سنجی مادون قرمز
اغلب در جمعآوری دادههای مربوط به طیف سنجی تبدیل فوریه پروتئینها، از دوتریم اکسید به جای آب استفاده میشود زیرا آب معمولی نواری قوی به وجود میآورد که با منطقه آمید پروتئین همپوشانی دارد. نوار حاصل از
از منطقه آمیدی دور میشود.
تعدیل کننده نوترون
از آب سنگین در برخی راکتورهای هستهای به عنوان تعدیلکننده نوترون استفاده میشود. کاربرد آب سنگین در راکتور کند کردن حرکت نوترونها است بهصورتی که تمایل آنها به واکنش با اورانیوم-۲۳۵ شکافتپذیر بیشتر از اورانیوم-۲۳۸ باشد. در این فرایند نوترونها بدون انجام شکافت هستهای به دام انداخته میشوند. در ابتدای این مطلب به معرفی راکتور هستهای کاندو پرداختیم، این راکتور از همین تکنولوژی استفاده میکند.
برای انجام این فرایند میتوان از آب معمولی به جای آب سنگین استفاده کرد اما این روش معایبی دارد. یکی از این معایب این است که در صورت استفاده از آب سنگین به عنوان تعدیلکننده نوترون، باید از اوارنیوم غنی شده به جای اورانیوم طبیعی استفاده کرد زیرا آب معمولی نسبت به آب سنگین در جذب نوترون بهتر عمل میکند.
در گذشته از گرافیت نیز به عنوان تعدیلکننده نوترون استفاده میشد اما امروزه این روش منسوخ شده است. در این روش از آب معمولی به عنوان خنککننده استفاده میشد و نیازی به آب سنگین وجود نداشت. این روش به دلیل احتمال اشتعال گرافیت و وقوع فاجعه از رده خارج شده است. در حادثه چرنوبیل مسئول ایجاد فاجعه همین آتش گرفتن گرافیت مورد استفاده در راکتور هستهای به عنوان تعدیلکننده نوترون بود.
از آنجا که میتوان آب سنگین را به عنوان تعدیلکننده نوترون در حضور اوارنیوم غیر غنی مورد استفاده قرار دارد، و این لزوم به کارگیری اورانیوم غنی شده را از بین میبرد، نگرانیهایی در مورد اشاعه هستهای وجود دارد. با این روش میتوان با سرعت بالایی پلوتونیوم مورد نیاز برای ساخت سلاحهای هستهای را غنی سازی کرد زیرا جداسازی شیمیایی پلوتونیوم از سوخت هستهای به مراتب آسانتر از جداسازی ایزوتوپی اورانیوم-۲۳۵ از منبع طبیعی اورانیوم است. با این حال در کشورهای مختلف جهان از هر دو روش برای ساخت سلاحهای هستهای استفاده میشود.
از آنجا که آب سنگین میتواند یکی از اجزای مورد نیاز برای راکتور ساخت سلاح هستهای باشد تولید آن در مقیاس صنعتی در سراسر جهان بحث برانگیز است و باید تحت نظارت سازمانهای خاصی باشد. تمامی راکتورهای تولید آب سنگین تحت نظر آژانس بینالمللی انرژی هستهای هستند.
شناساگر نوترینو
شناساگر نوترینو (Neutrino Detector) دستگاهی فیزیکی است که برای مطالعه روی ذرات نوترینو ساخته شده است. از آنجا که برهمکنش نوترینوها با ذرات بسیار ضعیف است، نیاز به شناساگرهای بزرگ برای شناسایی تعداد قابل توجهی نوترینو است. این شناساگرها را برای ایزوله بودن در برابر پرتوهای کیهانی و پرتو زمینه در زیر زمین میسازند. در برخی از این شناساگرها از آب سنگین استفاده میشود.

چرا آب سنگین خطرناک است ؟
آب سنگین به ذات ماده خطرناکی نیست. هر چند توانایی این را دارد که در مقدار بسیار بالا برای بدن انسان ایجاد مسمومیت کند اما این دلیل وحشت موجود در سراسر دنیا از این ماده نیست. برای روشن شدن این موضوع توضیح مختصری در مورد وضعیت عنصر رادیواکتیو اوروانیم در صنایع هستهای مورد نیاز است.
اورانیوم طبیعی که با عدد جرمی ۲۳۸ موجود است توانایی ایجاد انفجار هستهای مخرب را ندارد. بنابراین برای به دست آوردن این توانایی باید به یکی از دو روش زیر عمل کرد.
- غنیسازی اوانیوم: در این فرایند اورانیوم-۲۳۸ با کمک روشهایی تبدیل به اورانیوم-۲۳۵ میشود. این اورانیوم غنی شده در صنایع هستهای به کار گرفته میشود.
- تبدیل به پلوتونیوم: این فرایند در راکتورهای آب سنگین رخ میدهد. بهصورتی که اورانیوم-۲۳۸ تحت بمباران نوترونی قرار میگیرد. برخی از اتمهای اورانیوم نوترون را به هسته خود جذب کرده و تبدیل به پلوتونیوم-۲۳۹ میشوند.
در زمان جنگ جهانی دوم، دانشمندان آلمانی و انگلیسی به این فرایند آگاه شدند و دانستند که میتوان از آن در تولید سلاحهای هستهای استفاده کرد. از آنجا که پتانسیل تولید سلاحهای هستهای تا به امروز نیز وجود دارد، آژانس بینالمللی انرژی اتمی بر راکتورهای هستهای در کشورهای مختلف نظارت میکند.
آب سنگین در بدن انسان
بدن انسان بهطور طبیعی مقداری برابر با ۵ گرم آب سنگین، دوتریم دارد که خطری برای بدن ندارد. اگر مقدار زیادی آب سنگین (بیش از ۵۰٪) با آب معمولی جایگزین شود، باعث ایجاد اختلال در کارکرد سلول و در نهایت مرگ آنها میشود.
نوشیدن آب سنگین
در اکثر موراد با صحبت از آب سنگین به یاد راکتورهای هستهای و مواد رادیواکتیو میافتیم اما باید بدانیم که آب سنگین خالص نه رادیواکتیو است و نه خطرناک. یعنی اگر در مقادیر کم نوشیده شود به بدن انسان آسیبی نمیرساند. اما اگر به مقدار زیاد نوشیده شود یا مدت زمان طولانی از این آب استفاده کنیم خطرناک است. مسمومیت با این آب علائمی مانند سرگیجه و افت فشار خون را به همراه خواهد داشت.
تاثیر آب سنگین بر سیستم های بیولوژیکی
ایزوتوپهای مختلف عنصرهای شیمیایی میتوانند از خود ویژگیهای شیمیایی متفاوتی بروز دهند اما این تفاوتها چنان اندک است که بهطور معمول تفاوتی در اثر بیولوژیکی آنها ایجاد نمیکند. با این حال از آنجا که جرم دوتریم نسبت به هیدروژن دو برابر میشود تغییرات بزرگتری نیز مورد انتظار است. مطالعاتی در این زمینه صورت گرفته است که در ادامه به بررسی آن خواهیم پرداخت.
آب سنگین روی چرخه خواب بهصورتی تاثیر میگذارد که طول هر چرخه را افزایش میدهد. این مطالعه روی سیستمهای تکسلولی، گیاهان، حشرهها، پرندهها و در نهایت موش انجام شده و نتایج مشابهی به دست آمده است. مکانیسم تاثیر آب سنگین بر چرخه خواب هنوز ناشناخته است.
آنزیمها که نوعی پروتئین هستند برای داشتن کارایی به پیوندهای هیدروژنی خود برای حفظ ساختار سوم اتکا دارند. از آنجا که پیوند هیدروژنی در جایگزینی با دوتریم نیروی بیشتری پیدا میکند، برخی آنزیمها در آب سنگین عملکردشان مختل میشود.
گیاهان اگر تنها با آب سنگین آبیاری شوند رشد نمیکنند و دانهها نیز در این شرایط جوانه نمیزنند زیرا آب سنگین تقسیم سلولی یوکاریوتی را با اختلال مواجه میکند.

باکتریها میتوانند در آبی که ۹۸٪ سنگین است زندگی کنند. در نهایت تمام اتمهای هیدروژن پروتئینشان با دوتریم جایگزین میشود. اگر آب بیش از ۵۰٪ سنگین باشد، سیستمهای چندسلولی در آن خواهند مرد.
تاثیر آب سنگین بر حیوانات
در مورد تاثیر آب سنگین بر بدن حیوانات مطالعات زیادی انجام شده است که در این بخش به برخی از آنها اشاره میکنیم. موشها و سگها با دوتره شده ۲۵٪ آب بدنشان، عقیم میشوند. پستانداران بعد از یک هفته نوشیدن آب سنگین و دوتره شده ۵۰٪ آب بدنشان خواهند مرد زیرا روند تقسیم سلولی در بدن آنها مختل میشود. مطالعهای بر موشهای دارای سرطان پوست ملانوما نشان داده است که دوتریم اکسید از رشد سلولهای سرطانی جلوگیری میکند.

مسمومیت با آب سنگین
برای اینکه ۲۵٪ تا ۵۰٪ آب بدن انسان دوتره شود، باید مقدار بسیار زیادی آب سنگین مصرف کند و این اتفاق نادر است. برای اینکه فرد مسموم شود و اولین علائم مسمومیت را از خود نشان دهد نیاز است که چندین روز متناوب تنها از منبع آب سنگین آن هم به میزان زیاد استفاده کند.

در مطالعات انسانی دوزهای خوراکی در حد گرم از آب سنگین به افراد داده میشود. گفتیم که از هر ۶۴۰۰ اتم هیدروژن یکی به صورت دوتریم است بنابراین یک فرد ۵۰ کیلوگرمی با بدنی متشکل از ۳۲ کیلوگرم آب، در خود آنقدری دوتریم دارد که ۵٫۵ گرم آب سنگین داشته باشد. بنابراین برای دوبرابر کردن میزان دوتریم بدن انسان به ۵٫۵ گرم آب سنگین نیاز است.
لزوم آگاهی
به دلیل اطلاعرسانی ناکافی بسیاری افراد تصور دارند که آب سنگین رادیواکتیو است. این باور غلط است زیرا میدانیم از بین ۳ ایزوتوپ هیدروژن تنها تریتیوم رادیواکتیو است و دوتریم این ویژگی را ندارد. از آنجا که آب سنگین میزان بسیار کمی تریتیوم در خود دارد، درست مانند آب معمولی که حاوی مقادری ناچیزی از آن است، رادیواکتیو نیست.

آب سنگین در تاریخ
آب سنگین اولین بار در سال ۱۹۳۲ و تنها چند ماه بعد از کشف دوتریم تولید شد. با کشف واکنش شکافت هستهای در سال ۱۹۳۸ و لزوم استفاده از تعدیلکننده نوترون که باعث به دام افتادن آنها میشد، از آب سنگین در تحقیقات انرژی هستهای بهره گرفته شد. از همان زمان آب سنگین یکی از اجزای حیاتی در راکتورها، چه راکتورهای تولید انرژی چه آنها که در تهیه ایزوتوپهای لازم برای سلاحهای هستهای کاربرد دارند، بوده است.
مزیت استفاده از این راکتورها این است که میتوان در آنها از اورانیوم طبیعی بهره برد، در نتیجه نیاز به استفاده از آرامکننده گرافیت و روبهرو شدن با خطرهای آن از بین میرود. بیشتر راکتورهای امروز از اورانیوم غنی شده و آب معمولی به عنوان تعدیلکننده استفاده میکنند.

کشف آب سنگین
دانشمند برنده جایزه نوبل، هارولد یوری در سال ۱۹۳۱ وجود دوتریم را کشف کرد و سپس توانست آن را در ساختار مولکول آب غنیسازی کند. استاد او، گیلبرت نیوتون لوییس در سال ۱۹۳۳ اولین نمونه آب سنگین خالص را از روش الکترولیز به دست آورد. در سالهای بعد از آب سنگین در مطالعات زیستی و برای بررسی عملکرد آن در بدن نیز استفاده شد. تولید عمده این ماده در سالهای اخیر و در مطالعات هستهای بوده است که در ادامه به بررسی آن خواهیم پرداخت.

آب سنگین در چه کشورهایی تولید می شود ؟
در سال ۱۹۳۴ شرکت تولید کننده آلومینیوم «نورسک هیدرو» اولین جایی بود که به تولید آب سنگین در مقیاس صنعتی پرداخت و باعث شد نام نروژ در ابتدای لیست کشورهای تولید کننده آب سنگین قرار بگیرد. در سال ۱۹۴۰ با هجوم آلمان نازی به نروژ این تسهیلات تولید، به اشغال در آمد. سپس در ابتدای دهه چهل متفقین نیز به این رقابت پیوستند و در سال ۱۹۴۴ پروژه منهتن توانست ۲۰ تن از این مایع باارزش را تولید کند. این مقدار برای پر کردن یک راکتور هستهای آب سنگین بیش از نیاز بود.

در برنامه سلاح هستهای آمریکا بیشتر از جایگزین آب سنگین یعنی گرافیت در راکتورهای هستهای استفاده میشود اما تولید آب سنگین همچنان برای موارد استفاده دیگر از دهه ۴۰ ادامه دارد. در حال حاضر کانادا و هند بیشترین آب سنگین جهان را تولید میکنند و از این آب سنگین برای تولید برق نیز بهره میبرند. ردههای پایینتر تولید آب سنگین به این کشورها اختصاص دارد.
- آرژانتین
- ایران
- رومانی
- روسیه
آب سنگین اراک
شروع به ساخت نیروگاه تولید آب سنگین در ایران در شهر خنداب استان اراک در سال ۱۳۷۴ اجرا شد. ابتدا قرار بود این نیروگاه در استان اصفهان بنا شود اما بعد اراک برای این کار در نظر گرفته شد. هدف از تولید آب سنگین بهرهبرداری از آن به تعدیلکننده و سردکننده فرایند غنیسازی اورانیوم بود.

ساخت این نیروگاه سالها طول کشید و در نهایت در ۴ شهریور سال ۱۳۸۵ تاسیس شد. آن زمان اعلام شد که راکتوری با توان ۴۰ مگاوات به مدت ۳ سال به تولید آب سنگین خواهد پرداخت. در سالهای بعد اولین حلال دوتره نیز در همین نیروگاه تولید شد.
سوالات متدوال
در ادامه، به برخی از سوالات متداول پیرامون آب سنگین پاسخ میدهیم.
فرمول شیمیایی آب سنگین چیست ؟
فرمول شیمیایی آب سنگین بهصورت
است.
آیا آب سنگین رادیو اکتیو است ؟
خیر، آب سنگین رادیواکتیو نیست. از آنجا که بیشتر مورد استفاده این مولکول در صنایع هستهای است به اشتباه آن را رادیواکتیو تصور میکنند. مقدار بسیار ناچیزی که از تریتیوم در آب سنگین وجود دارد، در آب معمولی نیز هست. بنابراین از این نظر با یکدیگر تفاوتی ندارند. با این حال آبی که به عنوان خنککننده در نیروگاههای هستهای مورد استفاده قرار میگیرند به دلیل بمباران دوتریم توسط نوترون حاوی مقدار تریتیوم بیشتری هستند.
آب سنگین چگونه تولید می شود ؟
آب سنگین از الکترولیز آب حاوی فلزهای قلیایی به دست میآید.
در الکترولیز تولید آب سنگین از چه آند، کاند و الکترولیتی استفاده می شود ؟
الکترولیت آب حاوی فلزهای قلیایی، آند ورقه نیکل حفرهدار و کاتد مفتول فولادی است.
نقطه جوش آب سنگین چند است ؟
نقطه جوش آب سنگین کمی بالاتر از آب معمولی و ۱۰۱٫۴ درجه سانتیگراد است.
کاربرد آب سنگین چیست ؟
از این آب به عنوان تعدیلکننده نوترون در راکتور هستهای استفاده میشود. همچنین در طیفسنجی روزونانس مغناطیس هستهای هیدروژن کاربرد دارد.
آیا می توان به گیاهان آب سنگین داد ؟
خیر، گیاهان اگر تنها با آب سنگین آبیاری شوند، رشد نمیکنند و در نهایت میمیرند زیرا سلولها یوکاریتی در حضور آب سنگین امکان تقسیم ندارند.
فرمول شیمیایی آب فوق سنگین چیست ؟
آب فوق سنگین با فرمول شیمیایی
نشان داده میشود.
آیا آب سنگین سمی است ؟
خیر از آنجا که آب سنگین حاوی دوتریم غیر رادیواکتیو است، سمی نیست اما مصرف مقادیر زیاد این آب باعث بروز علائمی مانند افت فشار خون و سرگیجه میشود.
چرا یخ حاصل از آب سنگین روی آب معمولی نمی ماند ؟
از آنجا که چگالی آب سنگین از آب معمولی بیشتر است، یخ آب سنگین در لیوان آب معمولی به زیر آب میرود.
آب در چه حالتی رادیواکتیو است ؟
آب معمولی
و آب سنگین رادیواکتیو نیستند اما آب فوق سنگین که حاوی تریتیوم باشد
به دلیل رادیواکتیو بودن ایزوتوپ تیریتیوم، رادیواکتیو است.
فرمول شیمیایی آب نیمه سنگین چیست ؟
فرمول شیمیایی آب نیمهسنگین بهصورت
است.
آب سنگین چه زمانی کشف شد ؟
از آنجا که آب سنگین به میزان بسیار کمی در طبیعت وجود دارد بهتر است برای آن به جای «کشف» از «جداسازی» استفاه کنیم. دوتریم در سال ۱۹۳۱ کشف شد و در پی آن اولین نمونه آب سنگین خالص دو سال بعد یعنی در ۱۹۳۳ تولید شد.
جمع بندی
در این مطلب متوجه شدیم که آب سنگین چیست و چه موارد کاربردی دارد. همچنین در مورد ویژگیهای شیمیایی و فیزیکی آن صحبت کردیم و روش تهیه آن را مورد بررسی قرار دادیم. در مورد تاثیر آب سنگین بر سیستمهای زیستی از جمله بدن انسان صحبت کردیم و به سوالات پرتکرار در این زمینه پاسخ دادیم.




