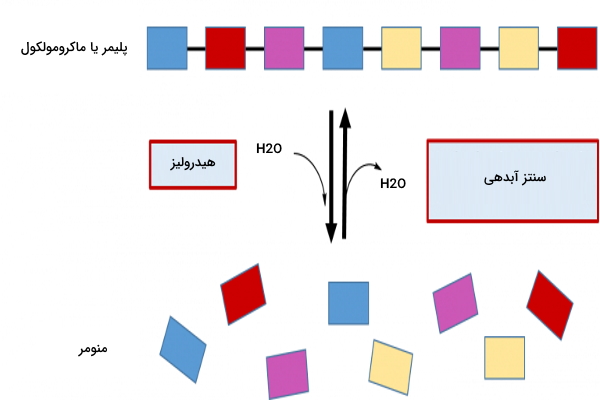
واکنش آنزیمی به واکنش شیمیایی گفته میشود که سرعت انجام آن توسط آنزیمها افزایش پیدا کرده است. آنزیمها با کاهش انرژی فعالسازی یا اکتیواسیون، سرعت واکنش را بالا میبرند و در انتهای واکنش دست نخورده باقی میمانند. در ادامه توضیحات بیشتری در خصوص واکنش آنزیمی و انواع آن، سینتیک آنزیم و عوامل موثر بر سینتیک و همچنین مکانیزمهای مختلف برای عمل کاتالیزوری آنزیم ارائه میشود.
واکنش آنزیمی چیست ؟
برای اینکه واکنش آنزیمی را تعریف کنیم بهتر است ابتدا تعریف واکنش شیمیایی را بدانیم. زمانی که مولکولها با هم برهمکنش میکنند، یک پیوند شیمیایی را ایجاد میکنند یا از بین میبرند، که به آن واکنش شیمیایی میگوییم. برخی واکنشها با قرار دادن دو واکنشدهنده در نزدیکی هم به طور خودبخودی پیش میروند ولی برخی از واکنشها برای انجام شدن نیازمند انرژی اولیه هستند.
در واکنشهای خودبخودی انرژی آزاد واکنش (اختلاف بین انرژی آزاد محصول و واکنشدهنده یا همان
) منفی و واکنشهایی که خودبخود انجام نمیشوند، انرژی آزاد مثبت است. بیشتر واکنشهای شیمیایی در دنیای زیستی نیاز به انرژی اولیه دارند ولی واکنشهایی که به طور خودبخودی انجام میشوند نیز بسیار کند هستند و نمیتوانند پاسخگوی نیاز سلولهای بدن باشند. حال آنکه وجود آنزیم در واکنش به عنوان یک کاتالیزور عمل میکند و سرعت این واکنشها را افزایش میدهد.
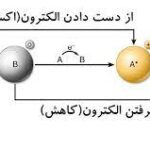
از اینرو به واکنشهایی که آنزیمها در آن شرکت دارند واکنش آنزیمی میگوییم. توجه کنید که آنزیمها تاثیری بر انرژی آزاد واکنش یا همان انجام شدن خودبخودی یا غیرخودبخودی ندارند و با کاهش انرژی فعالسازی (
) اثر کاتالیزوری خود را میگذارند. این موضوع در تصویر زیر نشان داده شده است.
انواع واکنش های آنزیمی
از آنجا که بیشتر واکنشهایی که در بدن موجودات زنده انجام میشوند نیاز به آنزیمی اختصاصی دارند، با تعداد زیادی از آنزیمهای مختلف در سلول مواجه هستیم. برای مثال تنها در ژنوم انسان، حدود ۲۰۰۰۰۰ پروتئین مختلف رمزگذاری میشود که هزاران ژن از آن را آنزیمها تشکیل میدهند. خبر خوب این است که میتوان آنزیمها را بر اساس نوع واکنش آنزیمی که انجام میدهند، در هفت گروه اصلی تقسیم بندی کرد که شامل:
- «اکسایش و کاهش» (Oxidoreductases) یا همان اکسیدوردکتاز
- ترنسفراز (Transferases)
- هیدرولاز (Hydrolases)
- لیاز (lyase)
- ایزومراز (Isomerases)
- لیگاز (ligases)
- ترنسلوکاز (Translocase)
در بخش بعد به توضیح واکنشهایی که انواع آنزیمها در آن دخیل هستند میپردازیم.
واکنش آنزیمی اکسایش و کاهش یا ردوکس (Redox)
در بیوشیمی آنزیمهایی که انتقال الکترون را از یک ماده به ماده دیگر کاتالیز میکنند، آنزیمهای اکسیدوردکتاز میگویند. در این واکنشها مادهای که دهنده الکترون یا هیدروژن است، اکسید و مادهای که گیرنده الکترون یا هیدروژن است، احیا نام دارد. فرمول واکنش ردوکس به شرح زیر است.
این گروه از آنزیمها معمولا برای انجام واکنش اکسایش و کاهش از
یا
به عنوان کوفاکتور در واکنش آنزیمی استفاده میکنند. آنزیمهای اکسیدوردکتاز مجموعه وسیعی از آنزیمها را در برمیگیرند که برای بررسی راحتتر، آنها را در ۲۱ زیرگروه تقسیم میکنند. اساس نامگذاری این زیرگروهها بر مبنای گروهی است که تحت تاثیر این آنزیمها، اکسید یا احیا میشوند. برای شناسایی راحتتر آنزیمها که در چه گروهی قرار دارند و با چه روشی کاتالیز را انجام میدهند، به هر آنزیم یک کد انگلیسی و یک دنباله چهار رقمی به نام عدد گروه آنزیم (Enzyme Commission Number | EC Number) اختصاص داده شده است. که در ادامه به این خاطر که تنها تا زیر گروه دوم معرفی شدهاند، عدد دو رقمی را مشاهده میکنید.
- زیرگروه EC ۱.۱: گروه CH-OH دهنده الکترون
- زیرگروه EC ۱.۲: گروه آلدهید یا اکسو (oxo) دهنده الکترون
- زیرگروه EC ۱.۳: گروه CH-CH دهنده الکترون
- زیرگروه EC ۱.۴: گروه
- دهنده الکترون
- زیرگروه EC ۱.۵: گروه CH-NH دهنده الکترون
- زیرگروه EC ۱.۶: روی NADP یا NADPH
- زیرگروه EC ۱.۷: ترکیبات نیتروژنی دهنده الکترون
- زیرگروه EC ۱.۸: گروه گوگرد دهنده الکترون
- زیرگروه EC ۱.۹: گروه هم (Heme) دهنده الکترون
- زیرگروه EC ۱.۱۰: دیفنول یا ترکیبات مربوط به آن
- زیرگروه EC ۱.۱۱: پراکسید به عنوان گیرنده الکترون
- زیرگروه EC ۱.۱۲: هیدروژن به عنوان گیرنده الکترون
- زیرگروه EC ۱.۱۳: در واکنشی که این آنزیمها انجام میدهند، مولکول اکسیژن به یک دهنده اضافه میشود.
- زیرگروه EC ۱.۱۴: در واکنشی که این آنزیمها انجام میدهند، مولکول اکسیژن به دو دهنده اضافه میشود.
- زیرگروه EC ۱.۱۵: رادیکال سوپراکسید به عنوان گیرنده الکترون
- زیرگروه EC ۱.۱۶: در واکنشی که این آنزیمها انجام میدهند، یونهای فلزی اکسید میشوند.
- زیرگروه EC ۱.۱۷: گروه CH یا
- زیرگروه EC ۱.۱۸: پروتئین آهن-گوگرد به عنوان دهنده الکترون
- زیرگروه EC ۱.۱۹: فلاودوکسین احیا شده به عنوان دهنده الکترون
- زیرگروه EC ۱.۲۰: فسفر یا آرسنیک در دهنده الکترون
- زیرگروه EC ۱.۲۱: واکنش روی
و صورت میگیرد تا پیوند بین
- تشکیل شود.
آنزیمهای اکسیدوردکتاز نقش مهمی در متابولیسم هوازی و بیهوازی ایفا میکنند. آنها در چرخه کربس، گلیکولیز، فسفریلاسیون اکسیداتیو و متابولیسم آمینواسید یافت میشوند. در گلیکولیز، آنزیم گلیسرآلدهید-۳-فسفات دهیدروژناز، احیای
به NADH را کاتالیز میکند و به منظور حفظ وضعیت اکسید و احیای سلول، مولکول NADH در مسیر فسفریلاسیون اکسیداتیو دوباره به
اکسید میشود. در گلیکولیز بیهوازی نیز، هنگامی که پیروات به لاکتات احیا میشود، اکسیداسیون NADH صورت میگیرد. همچنین لاکتات دوباره در سلولهای عضلات یا کبد به پیروات اکسید میشود.
واکنش آنزیمی انتقال گروه عاملی
آنزیمهایی که انتقال یک گروه عاملی (مانند گروه فسفات یا متیل) را از یک مولکول به مولکول دیگر کاتالیز میکنند، آنزیمهای ترنسفراز نامیده میشوند. فرمول شیمیایی انجام این واکنش به شرح زیر است.
معمولا نامگذاری ترنسفرازها بر اساس مولکول پذیرنده گروه عاملی به علاوه نوع گروه عاملی، انجام میشود. برای مثال DNA متیلترنسفراز آنزیمی است که واکنش انتقال گروه متیل را به DNA انجام میدهد. آنزیمهای ترنسفراز بر اساس انتقال گروه عاملی به نه زیر گروه تقسیم میشوند که به شرح زیر است.
- زیرگروه EC ۲.۱: آنزیمهایی که یک گروه کربن انتقال میدهند (متیل ترنسفرازها).
- زیرگروه EC ۲.۲: آنزیمهایی که گروه آلدهید یا کتون انتقال میدهند.
- زیرگروه EC ۲.۳: آنزیمهایی که گروه آسیل انتقال میدهند.
- زیرگروه EC ۲.۴: آنزیمهایی که یک واحد منوساکارید انتقال میدهند (گلیکوزیل ترنسفراز)
- زیرگروه EC ۲.۵: آنزیمهایی که گروه آلکیل یا آریل انتقال میدهند.
- زیرگروه EC ۲.۶: آنزیمهایی که گروه نیتروژنی انتقال میدهند (ترنس آمیناز).
- زیرگروه EC ۲.۷: آنزیمهایی که گروههای شیمیایی حاوی فسفر انتقال میدهند (کیناز و پلیمراز).
- زیرگروه EC ۲.۸: آنزیمهایی که گروههای شیمیایی حاوی گوگرد انتقال میدهند.
- زیرگروه EC ۲.۹: آنزیمهایی که گروههای شیمیایی حاوی سلنیوم انتقال میدهند.
واکنش آنزیمی هیدرولیز (آبکافت)
واژه هیدرولیز از هیدرو به معنای آب و لیز به معنای شکستن تشکیل شده است. به این معنی که در واکنش هیدرولیز از مولکول آب برای شکستن پیوند استفاده میشود. فرمول پیشنهادی هیدرولیز به شرح زیر است.
آنزیمهای هیدرولاز برای انجام واکنش آنزیمی هیدرولیز، معمولا از مولکولهای آب به عنوان دهنده گروه هیدروکسیل استفاده میکنند که باعث شکستن یا هیدرولیز پیوند شیمیایی در واکنش دهنده میشوند. در واقع این آنزیمها در بدن، مولکولهای بزرگ و پیچیده را به مولکولهای کوچکتر و سادهتر تبدیل میکنند. هضم مولکولهای غذا در بدن ما عمدتا توسط واکنش هیدرولیز انجام میشود. این گروه آنزیمی هم مشابه گروههای آنزیمی قبلی، بر اساس پیوند شیمیایی که از بین میبرند، به ۱۳ زیرگروه تقسیم میشوند که در ادامه توضیح داده شده است.
- زیرگروه EC ۳.۱: پیوند استری
- زیرگروه EC ۳.۲: قندها
- زیرگروه EC ۳.۳: پیوند اتری
- زیرگروه EC ۳.۴: پیوند پپتیدی
- زیرگروه EC ۳.۵: پیوند کربن-نیتروژن
- زیرگروه EC ۳.۶: اسید انیدراز
- زیرگروه EC ۳.۷: پیوند کربن-کربن
- زیرگروه EC ۳.۸: پیوند هالیدی
- زیرگروه EC ۳.۹: پیوند فسفر-نیتروژن
- زیرگروه EC ۳.۱۰: پیوند گوگرد-نیتروژن
- زیرگروه EC ۳.۱۱: پیوند کربن- فسفر
- زیرگروه EC ۳.۱۲: پیوند گوگرد-گوگرد
- زیرگروه EC ۳.۱۳: پیوند کربن-گوگرد
واکنش آنزیمی اضافه و حذف کردن چیست؟
در این واکنش آنزیمی، آنزیم لیاز پیوند شیمیایی بین مولکولها را از بین میبرد و معمولا پیوند شیمیایی جدیدی مانند پیوند دوگانه یا تشکیل حلقه در محصول واکنش به وجود میآورد. اگر فرمول انجام این واکنش را با فرمول سایر واکنشها مقایسه کنید، متوجه میشوید که در واکنش رو به جلوی این آنزیم تنها از یک واکنشدهنده استفاده میشود.
آنزیمهای لیاز بر اساس اثرگذاری روی پیوند شیمیایی به شش زیر گروه تقسیم میشوند، که در ادامه توضیح داده شده است.
- زیرگروه EC ۴.۱: پیوند کربن-کربن
- زیرگروه EC ۴.۲: پیوند کربن-اکسیژن
- زیرگروه EC ۴.۳: پیوند کربن-نیتروژن
- زیرگروه EC ۴.۴: پیوند کربن-گوگرد
- زیرگروه EC ۴.۵: پیوند کربن-هالید
- زیرگروه EC ۴.۶: پیوند فسفر-اکسیژن
واکنش آنزیمی ایزومریزاسیون (Isomerization)
برای توضیح این واکنش آنزیمی ابتدا باید با واژه ایزومر آشنا شویم. ایزومرها ترکیباتی هستند که فرمول شیمیایی یکسانی (اتمهای یکسان) دارند ولی جهتگیری آنها در فضا یا به عبارتی فرمول ساختاری متفاوت دارند. آنزیمهای ایزومراز با شکستن و ایجاد پیوند جدید در واکنشدهنده جهتگیری آن را در فضا تغییر میدهند.
در واقع مولکول را از یک ایزومر به ایزومر دیگر تغییر میدهند. برای مثال آنزیم فسفوگلیکوموتاز، گلوکز-۱-فسفات را به گلوکز-۶-فسفات تغییر میدهد یعنی فسفات را از کربن شماره ۱ جدا و به کربن شماره ۶ متصل میکنند. فرمول پیشنهادی این واکنش به صورت زیر است.
ایزومرازها به پنج زیرگروه آنزیمی تقسیم میشوند که در ادامه به توضیح آن میپردازیم.
- زیرگروه EC ۵.۱: راسمازها (Racemases) و اپیمرازها (Epimerases)، آنزیمهایی هستند که وضعیت شیمی فضایی مولکول را در محل وجود کربن کایرال برعکس میکنند.
- زیرگروه EC ۵.۲: سیس – ترانس ایزومرازها (Cis-Trans Isomerases)، آنزیمهایی که وضعیت سیس و ترنس مولکول را تغییر میدهند.
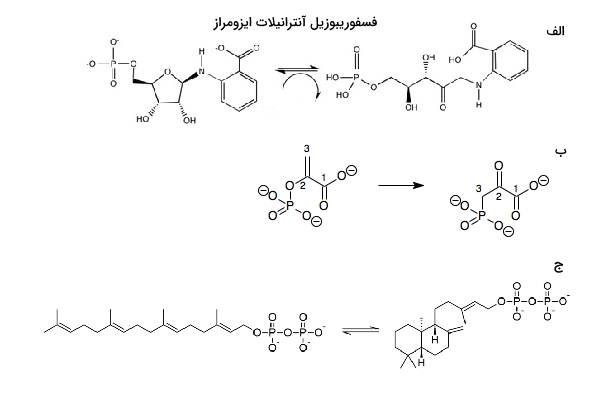
- زیرگروه EC ۵.۳: اکسیدوردکتازهای درونمولکولی (Intramolecular Oxidoreductases) آنزیمهایی هستند که الکترون را از یک بخش مولکول به بخش دیگر آن منتقل میکنند. در واقع به طور همزمان یک بخش از مولکول را احیا کرده و بخش دیگر را اکسید میکنند (تصویر زیر بخش الف).
- زیرگروه EC ۵.۴: ترانسفرازهای درونمولکولی (Intramolecular Transferases) آنزیمهایی هستند که گروه عاملی را از یک بخش به بخش دیگر مولکول انتقال میدهند (تصویر ب).
- زیرگروه EC ۵.۵: لیازهای درونمولکولی (Intramolecular lyases) واکنشی را تسهیل میکنند که در آن یک گروه در مولکول میتواند از مولکول جدا شود و پیوند دوگانه به جا بگذارد و از طرفی با پیوند کووالانسی به قسمت دیگری از مولکول اتصال پیدا کنند (تصویر ج).
واکنش آنزیمی اتصال (Ligation)
در واکنش آنزیمی اتصال، آنزیم لیگاز (سنتتاز) با مصرف انرژی پیوند کووالانسی جدید بین دو مولکول ایجاد میکند و به این ترتیب مولکولها به یکدیگر متصل میشوند. فرمول زیر برای واکنش آنزیمی اتصال پیشنهاد شده است.
برای مثال آنزیم DNA-لیگاز با مصرف ATP یا
(انرژی رایج درون در بدن)، باعث ایجاد پیوند فسفو دیاستر بین گروه ‘۵-فسفات و ‘۳-هیدروکسیل در DNA دو رشتهای میشود و نقش مهمی در رونویسی، بازآمیزی و ترمیم DNA ایفا میکند. آنزیمهای لیگاز بر اساس پیوندی که در مولکول ایجاد میکنند به شش زیرگروه تقسیم میشوند.
- زیرگروه EC ۶.۱: پیوند کربن-اکسیژن
- زیرگروه EC ۶.۲: پیوند کربن-گوگرد
- زیرگروه EC ۶.۳: پیوند کربن-نیتروژن
- زیرگروه EC ۶.۴: پیوند کربن-کربن
- زیرگروه EC 6.۵: پیوند فسفودی استر
- زیرگروه EC ۶.۶: پیوند نیتروژن-فلز
واکنش آنزیمی تغییر محل (Translocation)
تا سال ۱۹۶۱، تقسیمبندی آنزیمها بر اساس واکنش شیمیایی به شش مورد بالا خلاصه میشد. اما در این تقسیمبندی هیچ جایی برای گروه مهمی از آنزیمها که یونها و مولکولها را در طول غشای سلول عبور میدادند، وجود نداشت. به همین دلیل گروه آنزیمی ترنسلوکاز به طبقهبندی آنزیمها اضافه شد. در واقع این آنزیمها در انتقال فعال نقش دارند. یعنی مولکول یا یون را با مصرف انرژی، خلاف جهت شیب غلظت (انتقال مولکول از بخشی که غلظت کمی وجود دارد به سمتی که غلظت بیشتری از این مولکول وجود دارد) انتقال میدهند. فرمول این واکنش به صورت زیر است:
این آنزیمها به شش زیرگروه تقسیم میشوند که در ادامه به آن میپردازیم.
- زیرگروه EC ۷.۱: آنزیمهایی که انتقال هیدرون (کاتیون اتم هیدروژن) را تسهیل میکنند. برای مثال آنزیم ATP سنتتاز.
- زیرگروه EC ۷.۲: آنزیمهایی که انتقال کاتیونهای غیرآلی (کاتیونهای فلزی) را تسهیل میکنند. برای مثال پمپ
- .
- زیرگروه EC ۷.۳: آنزیمهایی که انتقال آنیونهای غیرآلی را تسهیل میکنند.
- زیرگروه EC ۷.۴: آنزیمهایی که انتقال آمینواسیدها و پپتیدها را تسهیل میکنند.
- زیرگروه EC ۷.۵: آنزیمهایی که انتقال کربوهیدرات و مشتقات آنها را تسهیل میکنند.
- زیرگروه EC ۷.۶: آنزیمهایی که انتقال سایر ترکیبات را تسهیل میکنند.
آنزیم ها چگونه نقش کاتالیزوری خود را انجام میدهند؟
آنزیمها برای کاهش انرژی فعالسازی از روشهای مختلفی برای نقش کاتالیزوری خود بهره میگیرند که شامل کاتالیز کووالان، اسید و باز، الکترولیز و کاتالیز از طریق نزدیکسازی است. این موارد در فهرست زیر آورده شده است.
- کاتالیز کووالان
- اسید و باز
- الکترواستاتیک
- کاتالیز از طریق نزدیکسازی
بیشتر آنزیمها، از بیش از یک یا دو روش برای انجام واکنش کاتالیکی استفاده میکنند که در ادامه به توضیح هر روش میپردازیم. اما قبل از آن بهتر است به توضیح مسایل پایهای در مورد حالت گذار و انرژی فعالسازی بپردازیم.
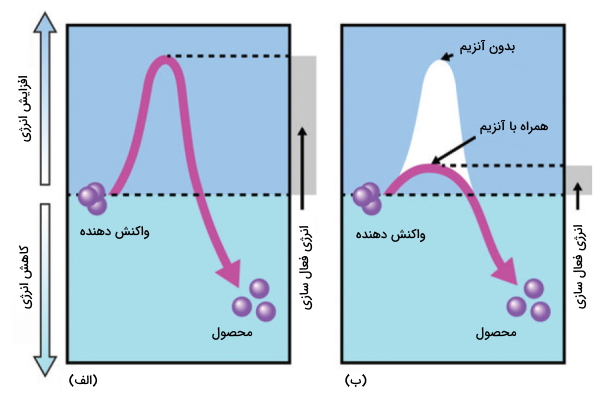
در حین انجام واکنش شیمیایی، مولکول موقتی بین واکنشدهنده و محصول به وجود میآید که نه میتوان آن را واکنشدهنده و نه محصول نامید. به این مولکول حالت انتقالی (گذار) میگویند. مولکول در حالت انتقالی به دلیل داشتن بیشترین انرژی آزاد، بسیار ناپایدار است. اختلاف انرژی آزاد گیبس بین حالت انتقالی و واکنشدهنده را انرژی آزاد فعالسازی مینامند و با ′ΔG نمایش میدهند. اگر به تصویر زیر توجه کنیم، میبینیم که انرژی آزاد فعالسازی روی انرژی آزاد واکنش (اختلاف بین انرژی آزاد محصول و واکنشدهنده) تاثیری ندارد.
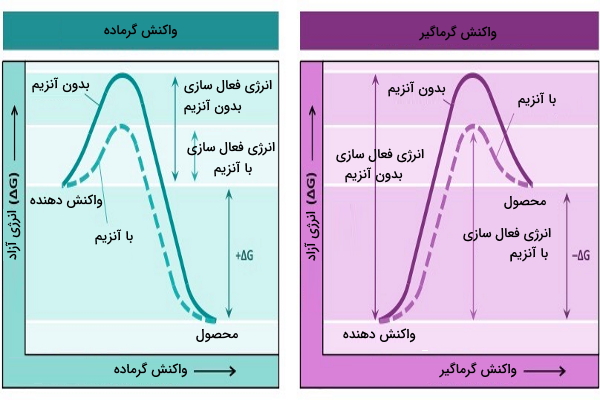
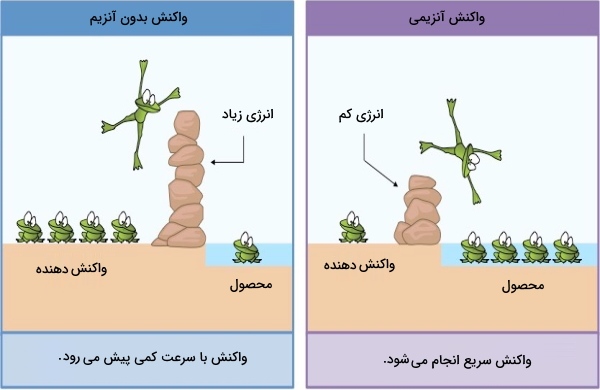
آنزیمها با کاهش انرژی فعالسازی سرعت واکنش را افزایش میدهند بدون اینکه تاثیری بر ΔG واکنش بگذارند. به علت انرژی فعالسازی کمتر برای تشکیل حالت انتقال در زمان حضور آنزیم، مولکولهای بیشتری به انرژی لازم برای حالت انتقالی دست پیدا میکنند و به این ترتیب تعدادی بیشتری محصول در زمان کوتاهتری به وجود میآید.
وقتی آنزیم با واکنشدهنده مکمل خود در جایگاه فعال اتصال پیدا کرد، انرژی آزادی ایجاد میشود که به آن انرژی پیوند میگویند. بیشترین میزان انرژی پیوند هنگامی به وجود میآید که واکنشدهنده کاملا مکمل آنزیم باشد. علاوه بر این اتصال کامل واکنشدهنده و آنزیم وقتی اتفاق میافتد که واکنشدهنده در حالت انتقال (انرژی بالا و ناپایدار) باشد.
اتصال آنزیم به واکنشدهنده در حالت انتقال باعث پایدار شدن حالت انتقال میشود و انرژی فعالسازی را کاهش میدهد. انرژی پیوند نیز باعث کاهش انرژی فعالسازی و در نهایت، افزایش سرعت واکنش میشود. بخش اعظم قدرت کاتالیکی آنزیمها در نتیجه کنار هم قرار دادن واکنشدهندهها در یک جهت مناسب به دست میآید تا به تشکیل حالت انتقالی آنها کمک کند.
کاتالیز کووالان
در جایگاه فعال آنزیم گروههای عاملی مهمی وجود دارند که به انجام نقش کاتالیزوری آنزیم کمک میکنند. یکی از این کمکها، تشکیل پیوند کووالانسی موقت بین آنزیم و حداقل یکی از واکنشدهندههای موجود در واکنش است. در این مکانیزم، آنزیم دارای یک بخش فعال (معمولا ریشه نوکلئوفیل یا الکتروفیل) است که از طریق حمله نوکلئوفیلی یا الکتروفیلی با واکنشدهنده واکنش میدهد. گروه نوکلئوفیل میتواند RCOO-، RNH یا ROH باشد که در زنجیره جانبی آمینواسیدهای موجود در جایگاه فعال آنزیم وجود دارند یا میتواند اتم نیتروژن در حلقه ایمیدازول اسیدآمینه هیستیدین باشد. هنگامی که پیوند کووالان در مرحله گذار بین آنزیم و واکنشدهنده برقرار شد، شکستن پیوند و خارج کردن یک گروه از واکنشدهنده تسهیل میشود.
کاتالیز اسید باز
آنزیم توسط اسید یا باز واکنش آنزیمی را تسهیل میکند. انتقال پروتون یکی از رایجترین مکانیزمهایی است که توسط آنزیمها انجام میشود. کاتالیز اسید و باز خود به دو زیرگروه عمومی و اختصاصی تقسیم میشود. در کاتالیز اختصاصی اسید، یون هیدرونیوم
و در کاتالیز اختصاصی بازی یون هیدروکسید
به طور مستقیم در واکنش مصرف میشوند. همچنین pH محلول بر میزان انجام این واکنش تاثیر میگذارد. تجزیه قند سوکروز به گلوکز و فروکتوز در حضور سولفوریک اسید، مثالی از کاتالیز اختصاصی اسید است. همچنین اضافه شدن هیدروژن سیانید به آلدهید و کتون در حضور سدیم هیدروکسید نیز مثالی برای کاتالیز اختصاصی بازی است.
کاتالیز اسید و باز عمومی وقتی اتفاق میافتد که مولکولی به غیر از هیدرونیوم یا هیدروکسید، گیرنده یا دهنده پروتون باشند. برای مثال آنزیم کربنیک انیدراز از ریشه هیستیدین موجود در جایگاه فعال خود برای تسهیل برداشت یون هیدروژن از مولکول آب متصل به اتم روی و تولید یون هیدروکسید استفاده میکند. در کاتالیز اسید و باز عمومی، pH توسط سیستم بافری ثابت میماند.
کاتالیز الکترواستاتیک یا یون فلزی
در این کاتالیز، آنزیم با برقراری پیوندهای الکترواستاتیک بین جایگاه فعال خود و سوبسترا (واکنشدهنده) منجر به پایدار کردن حالت گذار میشود. پیوندهای الکترواستاتیک میتواند از نوع یونی، یوندوقطبی، دوقطبیدوقطبی یا آبگریز باشد. پیوند هیدروژنی (دوقطبیدوقطبی) یکی از رایجترین کاتالیزهای الکترواستاتیکی است که در جایگاه فعال آنزیم انجام میشود.
کاتالیز از طریق نزدیک سازی
واکنشدهندههای واکنش با اتصال به جایگاه فعال آنزیم به یکدیگر نزدیک میشوند و در جهتی قرار میگیرند که راحتتر با یکدیگر واکنش دهند. اتصال به آنزیم میزان آنتروپی چرخشی واکنشدهندهها را کم و از آزادانه حرکت کردن آنها در محلول جلوگیری به میکند. کاهش آنتروپی با آزاد شدن انرژی آزاد پیوند (انرژی که در پیوند بین آنزیم و واکنشدهنده به دست میآید) انجام میشود. همچنین هنگامی که واکنشدهندهها نزدیک یکدیگر در جایگاه فعال آنزیم قرار میگیرند به صورت یک مولکول واحد رفتار میکنند و واکنش درجه دوم را به واکنش درجه اول تبدیل میکنند. این کار میزان انجام واکنش را
تا
مرتبه افزایش میدهد.
سینتیک آنزیم چیست؟
بیایید تصور کنیم که شما در یک نمایشگاه ماشینهای رالی هستید. احتمالا سرعت ماشین برای شما از همه چیز مهمتر است. اما مسایل دیگری مانند زمان سرعت صفر تا صد ماشین نیز اهمیت دارد. شیمیدانها همین نظر را در خصوص مطالعه آنزیمها دارند. آنها میخواهند همه عوامل تاثیرگذار بر میزان انجام واکنش آنزیمی را درک کنند و با بررسی کینتیک آنزیمها، اطلاعات کاملی در موارد زیر بدست آورند.
- نحوه عملکرد آنزیم
- عوامل مهارکننده یا فعالکننده آن
- عوامل محیطی تاثیرگذار بر سرعت آنزیم
اطلاعات مربوط کینتیک آنزیمها معمولا روی نمودار نشان داده میشود. همچنین بررسی فعالیت آنزیمها به صورت پیوسته و ناپیوسته انجام میشوند.
در بررسی ناپیوسته، واکنشدهنده و آنزیم با هم ترکیب و میزان محصول بعد از طی زمان مشخصی اندازهگیری میشود. در روش پیوسته، تولید محصول از زمان ترکیب کردن واکنشدهنده و آنزیم در حین گذر زمان اندازهگیری میشود (نه بعد از طی زمان مشخص).
برای بررسی تولید محصول معمولا از ماده رنگی به نام کروموژن (Chromogen) استفاده میشود که میزان دقیق آن با روش طیف سنجی و رنگسنجی به دست میآید. برای توضیح بیشتر مثالی برای بررسی کینتیک آنزیمی در شرایط مختلف آورده شده است.
اولین مرحله بررسی کینتیک آنزیمی، ترکیب واکنشدهنده (محلول کروموژن) همراه محلول بافری (عدم تغییر pH) و آنزیم است. با قرار دادن این محلول در دستگاه اسپکتروفتومتر، تولید محصول رنگی اندازهگیری و بررسی میشود. معمولا در ابتدا محصول با غلظت بیشتری تولید میشود و پس از طی زمان از میزان محصول کاسته میشود. تصویر زیر نموداری از رابطه میان غلظت واکنشدهنده و آنزیم را نشان میدهد.
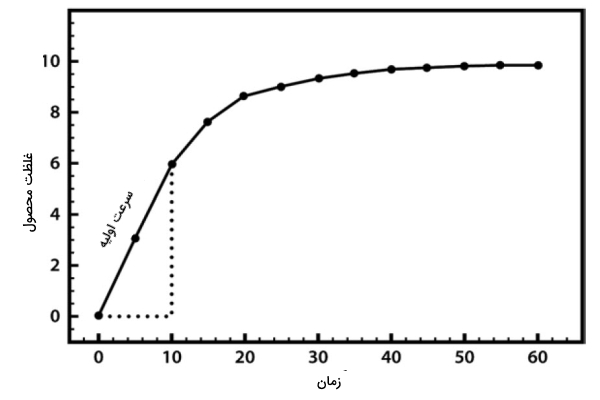
دلایل کاهش سرعت واکنش با گذشت زمان
دلایل متفاوتی برای کاهش سرعت واکنش آنزیمی در طول زمان وجود دارد. برخی از این دلایل به شرح زیر است.
- واکنشدهنده در ابتدای واکنش فراوان است و بهسرعت به محصول تبدیل میشود ولی با گذشت زمان از میزان واکنشدهنده کاسته میشود و سرعت تولید محصول نیز به دنبال آن کاهش مییابد.
- با گذر زمان در حین انجام آزمایش ممکن است آنزیم بدشکل شود و از کار بیافتد. در نتیجه این اتفاق سرعت واکنش کاهش مییابد.
- تغییر pH محلول در اثر مصرف یا آزادسازی پروتون نیز میتواند یکی از علتها باشد. آنزیمها در pH متفاوت با میزان بهینه از کار میافتند.
با توجه به تغییر شکل نمودار با گذشت زمان، محققان کینتیک آنزیم را قبل از تغییر یافتن نمودار بررسی میکنند تا بتوانند ناحیه خطی نمودار را رسم کنند. از ناحیه خطی نمودار میتوان سرعت اولیه آنزیم (
) را بدست آورد.
برای مراحل بعدی آزمایش میتوان این آزمایش را با تغییر دادن غلظت واکنشدهنده، آنزیم یا pH دوباره تکرار کرد و اثر این عوامل را بر روی سرعت اولیه سنجید. رابطه غلظت آنزیم با سرعت اولیه یک رابطه مستقیم و ساده است. با افزایش ۱۰٪ غلظت آنزیم سرعت واکنش ۱۰٪ افزایش مییابد. نمودار این آزمایش را در تصویر زیر مشاهده میکنید.
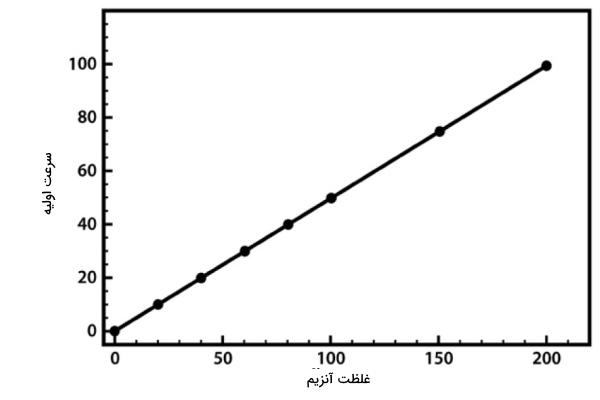
رابطه غلظت واکنشدهنده و سرعت واکنش کمی پیچیده است. با افزایش غلظت واکنشدهنده سرعت اولیه افزایش مییابد تا جایی که به سرعت بیشینه برسد و پس از آن سرعت کم میشود. علت این اتفاق میتواند اشباع شدن جایگاه فعال آنزیم از واکنشدهنده باشد که در تصویر زیر نمایش داده شده است.
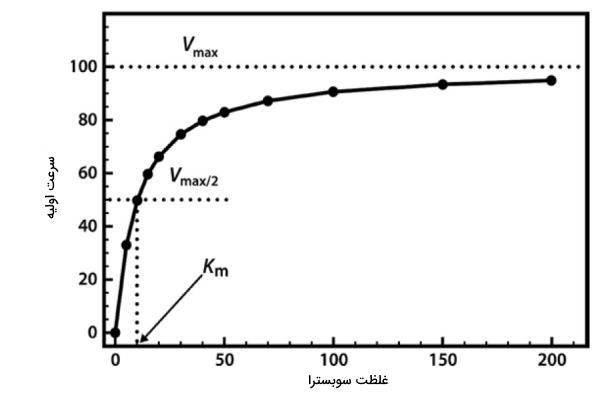
برای بدست آوردن سرعت اولیه واکنش از معادله ریاضی میکائیلیس-منتن (Michaelis–Menten) استفاده میکنند:
در معادله بالا:
- : به معنی سرعت اولیه
- : به معنای غلظت واکنشدهنده
- : سرعت ماکزیمم
- : ثابت میکائیلیس
ثابت میکائیلیس چه اطلاعاتی به ما می دهد؟
میزانی از واکنشدهنده است که سرعتی برابر با نصف سرعت ماکزیمم ایجاد میکند. پایین برای آنزیم به این معنی است که آنزیم برای اشباع شدن به میزان کمی واکنشدهنده نیاز دارد و در حضور غلظت پایین واکنشدهنده به سرعت ماکزیمم میرسد. از طرف دیگر بالا میزان بالای واکنشدهنده برای رسیدن به سرعت ماکزیمم آنزیم را نشان میدهد. در واقع نشان دهنده میزان تمایل آنزیم به واکنشدهنده است. از روی میزان
اطلاعات مهمی در رابطه با آنزیم بدست میآوریم که شامل موارد زیر است.
- آنزیمی با
- پایین در شرایط فیزیولوژیکی معمولا به سرعت اشباع میشود و همواره در حضور واکنشدهنده با سرعت ثابتی عمل میکند. یعنی تغییر سوبسترا اثری در سرعت انجام واکنش این آنزیم ندارد.
- آنزیمی با
- بالا در شرایط فیزیولوژیک به سرعت اشباع نشده و غلظت واکنشدهنده میتواند در سرعت انجام واکنش آن تاثیر بگذارد.
- اگر آنزیم با واکنشدهندههای مختلفی جفت شود، سوبسترایی که میزان km کمتری ایجاد میکند، سوبسترای طبیعی آنزیم است. البته این ویژگی ممکن است در همه آنزیمها صادق نباشد.
- اگر دو آنزیم مختلف (با سرعت ماکزیمم مشابه) در دو مسیر متابولیکی مختلف بر سر یک واکنشدهنده رقابت کنند با دانستن
میتوان متوجه شد که کدام مسیر متابولیکی پیش میرود. معمولا مسیر متابولیکی آنزیم با کمتر ترجیح داده میشود.
برای مثال آنزیم فسفوفروکتوکیناز، مرحله اول از مسیر گلیکولیتیک را کاتالیز میکند تا برای سلول ATP (انرژی مصرفی سلول) تولید کند. از طرفی آنزیم گلوکز-۱-فسفات یوریدیلترنسفراز منجر به تولید گلیکوژن (ذخیره انرژی سلول) میشود.
هر دوی این آنزیمها از هگزوزمنوفسفات به عنوان واکنشدهنده استفاده میکنند با این تفاوت که فسفوفروکتوکیناز کمتر از
- گلوکز-۱-فسفات یوریدیلترنسفراز برای این سوبسترا است. بنابراین هنگامی که میزان غلظت هگزوزمنوفسفات کم باشد، مسیری که فسفوفروکتوکیناز کاتالیز میکند به سرعت انجام میشود اما مسیر تولید گلیکوژن به کندی پیش میرود. در غلظت بالای واکنشدهنده نیز هر دو آنزیم فعال هستند. این به این معنی است که سلول تنها در شرایطی که غلظت هگزوزمنوفسفات فراوان است، آن را به صورت گلیکوژن ذخیره میکند و در غلظت کم تنها به تولید انرژی ضروری برای سلول میپردازد.
چگونه میزان
را از روی نمودار بدست آوریم؟
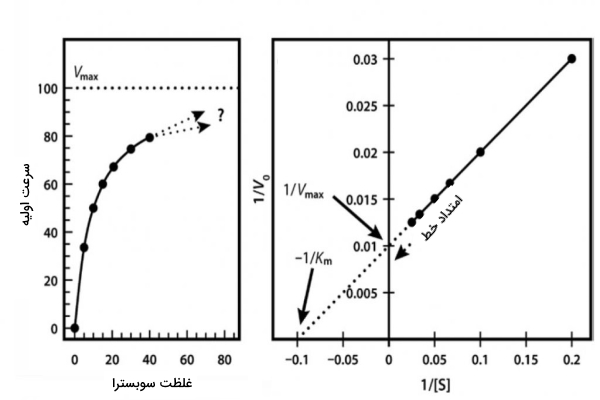
معمولا بدست آوردن میزان
به طور مستقیم از روی نمودار سرعت نسبت به واکنشدهنده امکانپذیر نیست. چراکه معمولا به غلظت بالایی از واکنشدهنده برای رسیدن به سرعت ماکزیمم و به دنبال آن محاسبه نیاز است. برای حل این مشکل نمودار را به شیوه دیگری ترسیم میکنند که رایجترین روش، رسم نمودار «لاینویور-برک» (Lineweaver–Burk) است. این روش با رسم نقاط به صورت نسبت به ، نمودار نمایی به نمودار خطی تغییر میکند. نمودار خطی را میتوان به راحتی تا نقطهای که به محور عمودی () و به محور افقی () مماس شود، ادامه داد. این نقاط مقادیر سرعت ماکزیمم و
را نشان میدهند. نمودار میکائیلیس-منتن و لاینویور-برک در تصویر زیر نمایش داده شده است.
چه چیزی سرعت واکنش آنزیمی را تغییر میدهد؟
برای انجام واکنشهای آنزیمی، نیازمند آنزیم هستیم و عملکرد این آنزیمها میتواند سرعت واکنش را تغییر دهد. عوامل زیادی شامل موارد زیر بر سرعت انجام واکنش آنزیمی تاثیر میگذارند.
- دما
- pH
- غلظت سوبسترا
- غلظت آنزیم
- وجود فعالکننده یا مهار کنندههای آنزیمی
در ادامه به توضیح هر یک از این عوامل میپردازیم.
غلظت آنزیم
افزایش میزان آنزیم باعث افزایش سرعت واکنش میشود. البته سرعت واکنش تا زمانی افزایش پیدا میکند که سوبسترا به اندازه کافی در اختیار آنزیم باشد. هنگامی که سوبسترایی برای اتصال آنزیم نباشد، افزودن آنزیم تغییری در سرعت واکنش ایجاد نمیکند.
دما
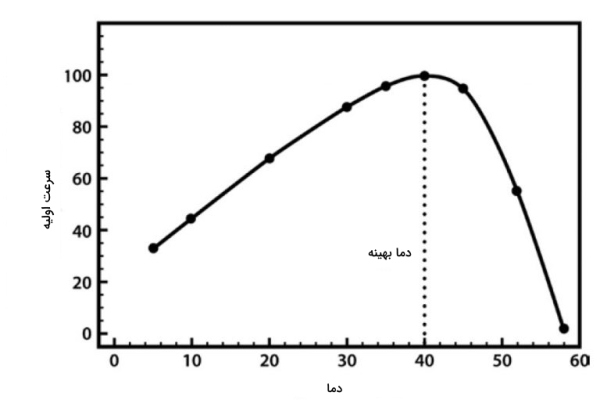
به طور کلی، افزایش دما تا دمای بهینه آنزیم باعث افزایش سرعت واکنش و کاهش دما باعث افت سرعت واکنش میشود. هنگامی که دمای محیط افزایش پیدا میکند سرعت حرکت مولکولها بیشتر میشود و به دنبال آن احتمال برخورد واکنشدهنده و آنزیم (نظریه برخورد) و انجام واکنش شیمیایی بیشتر میشود.
با اینحال، عمده آنزیمها ساختار پروتئینی دارند و بیشتر از دمای خاصی را تحمل نمیکنند و تغییر شکل میدهند. تغییر شکل آنزیم موجب از بین رفتن جایگاه فعال آن میشود. در نتیجه، واکنشدهنده به آنزیم اتصال پیدا نمیکند و واکنش آنزیمی انجام نمیشود.
دمای بهینه برای انجام واکنش در بدن انسان ۳۷٫۵ درجه سانتیگراد است. البته آنزیمهای بدن موجوداتی که در شرایط سخت محیطی مثل قطب یا چشمههای آب گرم زندگی میکنند دمای بهینه متفاوتی در مقایسه با بدن انسان دارند. برای مثال آنزیم تک پلیمراز که در PCR از آن استفاده میشود از باکتری «ترموس آکواتیکوس» (Thermus aquaticus) گرفته شده که میتواند دمای بالای ۷۰ درجه سانتیگراد را تحمل کند.
pH
تغییر در pH محیط میتواند جایگاه فعال آنزیم را تغییر دهد. pH بهینه برای هر آنزیمی به محلی بستگی دارد که به طور طبیعی در آن فعالیت میکند. مثلا آنزیمهای روده کوچک در شرایط قلیایی (بالای ۷٫۵) بهخوبی کار میکنند، اما آنزیمهای معده pH بهینهای در حدود ۲ (اسیدی) دارند.
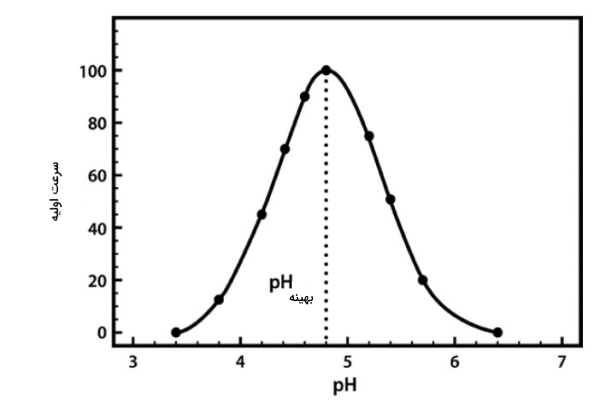
غلظت واکنش دهنده
افزایش واکنشدهنده سبب افزایش سرعت واکنش میشود. اما این افزایش سرعت تا زمانی ادامه پیدا میکند که جایگاه فعال آنزیم برای اتصال سوبسترا جای خالی داشته باشد. زمانی که تمامی جایگاه فعال آنزیمها از سوبسترا اشباع شود، افزودن سوبسترا به محیط تغییری در سرعت واکنش ایجاد نمیکند.
وجود مهار کننده آنزیم در محیط
مهارکنندههای آنزیم نوعی سوبسترا هستند که میتوانند فعالیت آنزیم را کند یا به طور کامل متوقف کنند. مهارکنندههای آنزیمی میتوانند به صورت موقت (برگشتپذیر) یا دائمی (برگشتناپذیر) باشند. مهار آنزیمی برگشتپذیر به سه دسته رقابتی (Competitive)، غیررقابتی (Non-competitive) و نارقابتی (Uncompetitive) تقسیم میشود.
- مهار رقابتی: زمانی اتفاق میافتد که سوبسترای اصلی و مادهای مشابه سوبسترا در محیط وجود داشته باشد. در این شرایط ماده مشابه سوبسترا میتواند در جایگاه فعال آنزیم قرار بگیرد و مانع از اتصال سوبسترا اصلی به آنزیم و انجام واکنش شود.
- مهار غیررقابتی: این نوع مهار که به تنظیم آلوستریکی نیز معروف است، هنگامی اتفاق میافتد که اتصال ماده مهارکننده به بخشی غیر از جایگاه فعال (بخش آلوستریک) آنزیم متصل میشود، ولی این اتصال شکل جایگاه فعال را طوری تغییر میدهد که سوبسترای اصلی نمیتواند به آن متصل شود. بخش آلوستریک آنزیم به هر بخشی به غیر از جایگاه فعال آن گفته میشود.
- مهار نارقابتی: این نوع مهار کننده وقتی سوبسترا به آنزیم متصل شد وارد عمل میشود و کمپلکس آنزیم-سوبسترا را مهار میکند.