آنزیمها کاتالیستهای زیستی در بدن موجودات زنده هستند. بدون این مولکولهای پیچیده پیشرفت واکنشهای چرخه کربس، گلیکوژنر، متابولیسم چربیها، گوارش پروتئینها، واکنشهای فتوسنتزی و هزاران واکنش زیستی دیگر غیرممکن است. آنزیمها بدون اینکه تغییری در ساختار آنها ایجاد شود، سرعت واکنشهای زیستی را افزایش میدهند. سینتیک واکنش های آنزیمی ، بخشی از بیوشیمی است که سرعت فعالیت آنزیمها و عوامل موثر بر آن را بررسی میکند. در این مطلب توضیح میدهیم سینتیک واکنش آنزیمی و عوامل تغییر آن چیست و در آخر با حل چند تمرین متغیرهای سینتیکی را محاسبه میکنیم.
ساختار آنزیم
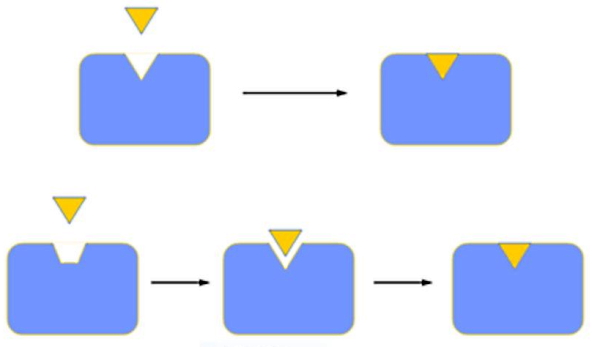
قبل از اینکه سینتیک واکنش های آنزیمی را بررسی کنیم، باید ساختار و عملکرد آنزیمها را بدانیم. با توجه به اینکه «آنزیمها» (Enzymes | E) مولکولهای پروتئینی با ساختار سوم و چهارم هستند، برای فعالیت بهینه به دما و pH خاصی نیاز دارند. برای مثال تریپسین و پپسین آنزیمهای گوارشی معده و روده هستند که پروتئینها را به پپتیدهای کوچک و آمینواسید تجزیه میکنند. پپسین برای فعالیت بهینه خود به pH بسیار اسیدی ۱٫۵ احتیاج دارد و pH بهینه برای فعالیت تریپسین ۸ است. شرایط بهینه فعالیت آنزیمها به واکنشی که کاتالیز میکنند و جایگاه آنها در سلول بستگی دارد. تغییر زیاد pH و دمای محیط ممکن است سبب تغییر کنفورماسیون جایگاه فعال شود و آنزیم را غیرفعال کند. جایگاه فعال، سوبسترا و مجموعه آنزیم-سوبسترا سه مفهوم مهم در بررسی آنزیمها هستند.
- «جایگاه فعال» (Active Site) توالی بسیار اختصاصی از آمینواسیدها و محلی است که واکنشها انجام میشود. بخشهای دیگر آنزیم مثل داربستی است که این توالی آمینواسیدی را کنار هم نگه میدارد.
- «سوبسترا» (Substrate | S) مادهای است که آنزیم روی آن اثر میگذارد.
- «مجموعه آنزیم-سوبسترا» (Enzyme-substrate Complex | ES) پس از اتصال سوبسترا به نیروهای بین مولکولی ضعیف (یونی یا واندوالس) با جایگاه فعال آنزیم تشکیل میشود.
برهم کنش آنزیم سوبسترا
نکته اصلی در اختصاصی عمل کردن هر آنزیم برهمکنش جایگاه فعال آنزیم با سوبسترای اختصاصی خود است. دو مدل اصلی برای این برهمکنش وجود دارد.
- «مدل قفل و کلید» (Lock and Key Model): در این مدل جایگاه فعال آنزیم کاملا مکمل سوبسترا است و نیاز به هیچ تغییری وجود ندارد.
- «مدل القایی» (Induced Fit Model): در مدل القایی جایگاه فعال تقریبا مکمل سوبسترا است اما برای اتصال و انجام واکنش تغییر کنفورماسیون آن ضروری است. بیشتر بیوشیمیستها این مدل را تایید میکنند.
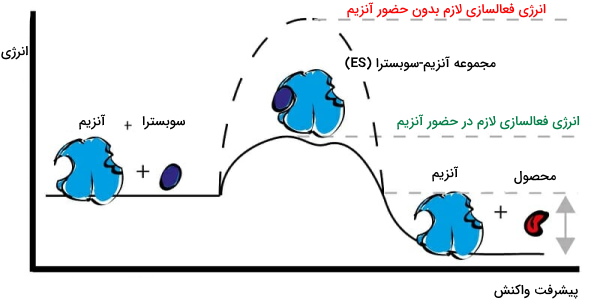
تغییر انرژی واکنش آنزیمی
آنزیم یک مسیر جایگزین برای انجام واکنشهای زیستی با کمترین انرژی فعالسازی ایجاد میکند. اتصال ضعیف آنزیم و سوبسترا و تغییر کنفورماسیون آنزیم، تمایل جایگاه فعال به سوبسترا را افزایش و انرژی لازم برای پیشبرد واکنش را کاهش میدهد.
سینتیک واکنش های آنزیمی
سینتیک واکنشهای آنزیمی بخشی از بیوشیمی است که سرعت تبدیل سوبسترا به محصول را بررسی میکند. واحد سرعت آنزیم، غلظت محصول بر واحد زمان (Product concentration /time) است. سینتیک واکنش های آنزیمی را با در نظر گرفتن چند پیشفرض بررسی میکنیم.
- غلظت آنزیم در واکنش ثابت است و تغییر نمیکند. با وجود اینکه در بدن موجودات زنده غلظت آنزیم برای انجام واکنشها تغییر میکند.
- اتصال سوبسترا به آنزیم و تبدیل سوبسترا به محصول در دو مرحله کاملا جدا انجام میشود.
- هیچ واکنش جانبی در مسیر تبدیل سوبسترا به محصول انجام نمیشود.
برای درک بهتر شیوه بررسی سرعت آنزیم، تصور کنید هر پنج دقیقه یکبار یک بیسکوئیت به شما تعارف میشود. در این مدت شما زمان کافی برای میل کردن هر بیسکوئیت دارید. حال فرض کنید تعداد بیسکوئیتها به دو عدد در هر پنج دقیقه برسد، احتمالا باز هم فرصت کافی برای میل کردن هر بیسکوئیت خواهید داشت. اما فرض کنید تعداد بیسکوئیتها به ۳۰ عدد در هر پنج دقیقه برسد و شما فرصت کافی برای میل کردن همه آنها در پنج دقیقه نداشته باشید و همچنان دو بیسکوئیت در پنج دقیقه میل کنید. در این حالت اگرچه بیسکوئیت بیشتری در اختیار شما قرار دارد اما شما توانایی میل کردن تعداد بیشتر را ندارید. همین اتفاق برای آنزیم میافتد و پس از رسیدن به حداکثر سرعت توانایی کاتالیز سوبسترای بیشتر را ندارد. در این حالت آنزیم اشباع شده است و سرعت واکنش آنزیمی ثابت باقی میماند.
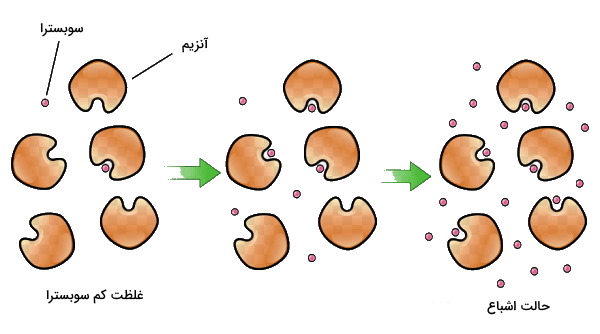
واکنشهای آنزیمی در سه مرحله اتصال سوبسترا به آنزیم، تشکیل مجموعه آنزیم-سوبسترا و تبدیل سوبسترا به محصول انجام میشود. سینتیک واکنش های آنزیمی در هر یک از این مراحل متفاوت است.
- «قبل از تعادل» (Pre-steady State): در ابتدای واکنش، جایگاه فعال به سرعت با سوبسترا پر میشود. اتصال سوبسترا-آنزیم تمایل آنزیم برای سوبسترا را افزایش میدهد.
- «حالت تعادل یا ثابت» (Steady State): با پیشرفت واکنش غلظت S و ES به تعادل میرسد و سرعت واکنش ثابت میشود. سرعتی که برای انجام واکنشهای آنزیمی گزارش میشود، سرعت این مرحله است.
- «بعد از تعادل» (Post-Steady State): با افزایش غلظت محصول و کاهش غلظت سوبسترا، سرعت واکنش در نهایت صفر خواهد شد. معادله زیر، واکنش آنزیمی را نشان میدهد.
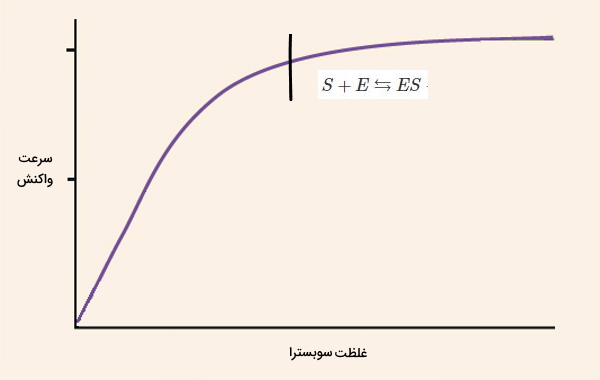
معادله زیر، واکنش کلی آنزیمها را نشان میدهد. به دلیل اینکه غلظت محصول در ابتدای واکنش بسیار کم است، در معادله کلی واکنش نادیده گرفته میشود و تبدیل مجموعه آنزیم-سوبسترا به محصول برگشتناپذیر است.
معادله میکائیلیس منتن در سینتیک واکنش های شیمیایی چیست ؟
معادله «میکائیلیس منتن» (Michaelis-Menten Kinetics) رابطه بین غلظت آنزیم و سوبسترا و سرعت واکنش را نشان میدهد. برای مطالعه بهتر سینتیک میکائیلیس منتن واکنش آنزیمی را در دو واکنش زیر در نظر بگیرید.
هر یک از واکنشهای رفت و برگشت بالا ثابت سرعت جداگانهای دارد و سرعت هر مرحله واکنش از حاصلضرب غلظت واکنشدهندهها و ثابت سرعت محاسبه میشود.
: ثابت اتصال سوبسترا به آنزیم و تشکیل مجموعه ES
: ثابت کاتالیکی تولید محصول
: ثابت تفکیک آنزیم و سوبسترا
: ثابت عکس واکنش کاتالیکی و تشکیل ES.
سینتیک میکائیلیس منتن با چند فرض چند فرض، سرعت کلی واکنش آنزیمی را از معادله زیر محاسبه میکند.
- غلظت محصول در ابتدای واکنش بسیار کم است و میتوان از مقدار
- محاسبه فرمول کلی سرعت صرف نظر کرد.
- سرعت تشکیل مجموعه ES و تفکیک آن، کمی پس از شروع واکنش به تعادل میرسد و سرعت ثابت میشود.
- آنزیم کاتالیستی است که در واکنش مصرف نمیشود و غلظت آن ثابت است. غلظت سوبسترا بسیار بیشتر از آنزیم و در بازه زمانی بسیار کوتاه از واکنش مقدار سوبسترای متصل به آنزیم بسیار کمتر از سوبسترای آزاد است. در این حالت میتوان گفت غلظت سوبسترای آزاد در بازه زمانی بسیار کوتاه در واکنش ثابت است و تغییری نمیکند.
- آنزیم در دو حالت آزاد و ES وجود دارد. در نتیجه غلظت آنزیم را میتوان از فرمول
- محاسبه کرد.
- تنها سرعت اولیه واکنش محاسبه میشود.
در نتیجه فرمول محاسبه سرعت کلی واکنش آنزیمی از مسیر زیر به دست میآید.
سرعت تشکیل ES
با توجه به شرط ۴ سرعت تشکیل ES را میتوان از معادله زیر حساب کرد.
سرعت شکسته شدن ES به
و
بستگی دارد و از فرمول زیر محاسبه میشود.
بر اساس فرض ۲، سرعت تشکیل و تفکیک ES ثابت است. پر نتیجه میتوان معادله سرعت آنها را برابر هم در نظر گرفت.
با تقسیم دو طرف معادله بالا به
میتوان مقادیر ثابت و متغیر را جدا کرد.
عدد ثابتی است که به آن ثابت میکائیلیس منتن یا
گفته میشود.
میتوان گفت معادله کلی سرعت در هر لحظه از واکنش بهوسیله معادله
محاسبه میشود. در نتیجه اگر معادله بالا را بر حسب [ES] بنویسیم و دو طرف معادله را در
ضرب کنیم، به معادله زیر میرسیم.
حداکثر سرعت واکنش آنزیمی زمانی ایجاد میشود که تمام آنزیمهای موجود به سوبسترا متصل شوند (
) پس میتوان گفت:
اگر
را در فرمول بالا جایگزین کنیم به معادله میکائیلیس منتن خواهیم رسید.
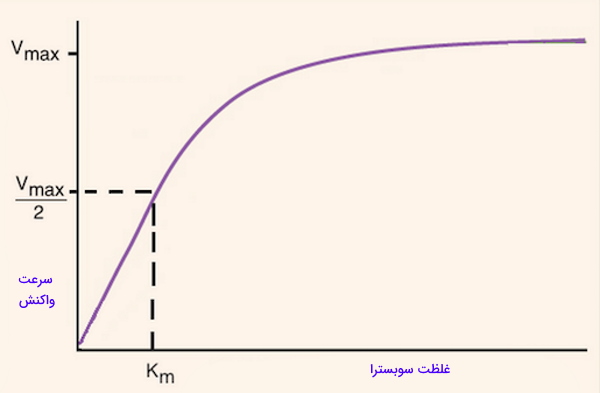
- : کمیتی است که بیشترین سرعت واکنش آنزیمی (حالت اشباع آنزیم) را نشان میدهد.
یا ثابت میکائیلیس: غلظتی از سوبسترا را نشان میدهد که سرعت واکنش در آن نصف است. علاوه بر رابطه غلظت سوبسترا با سرعت فعالیت آنزیم، تمایل آنزیم به سوبسترا را نشان میدهد. هر چه میزان این ثابت کمتر باشد نشاندهنده تمایل بیشتر آنزیم به سوبسترا است و نشان میدهد، غلظت کمتری از سوبسترا برای رسیدن به حداکثر سرعت واکنش نیاز است. اگر دو آنزیم مختلف یک واکنش یکسان را کاتالیز کنند، آنزیمی که پایینتری دارد با غلظت کمتر سوبسترا همان میزان محصول در واحد زمان را تولید میکند که آنزیم با بیشتر، تولید میکند. برای مثال آنزیم روبیسکو یکی از آنزیمهای کلیدی در فتوسنتز گیاهان است، این آنزیم برای مولکول
- بسیار پایین است به همین دلیل تعداد زیادی از آن در گیاهان تولید میشود.
- : سرعت تبدیل سوبسترا به محصول در واحد زمان است.
- : غلظت سوبسترا در هر مرحله از واکنش را نشان میدهد.
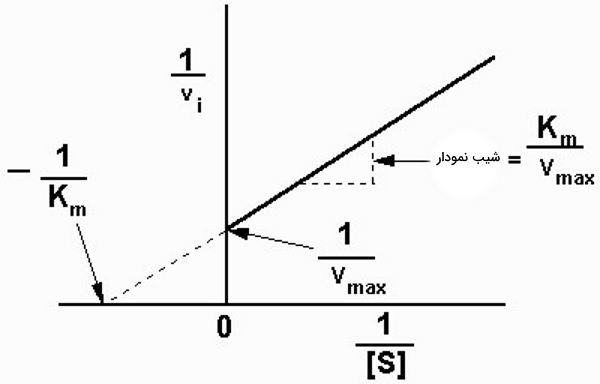
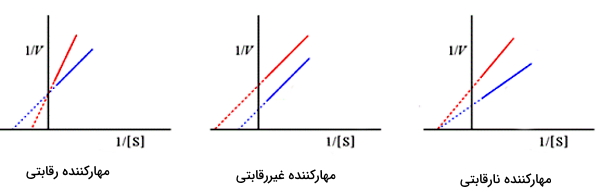
نمودار لینور برک
بخش ثابت منحنی سرعت-غلظت میکائیلیس منتن، کاملا خطی نیست و این یعنی
را میتوان در غلظت بینهایت سوبسترا محاسبه کرد. به همین دلیل لینور و برک (Lineweaver and Burk) برای محاسبه دقیقتر این پارامترها با معکوس کردن معادله میکائیلیس منتن نمودار جدیدی پیشنهاد کردند.
با جدا کردن مخرج
معادله خطی زیر به دست میآید. که در آن شیب خط و
عرض از مبدا نمودار عکس سرعت به عکس غلظت سوبسترا است.
شکل زیر نمودار لینور و برک برای در حضور انواع مهارکننده (نمودار قرمز) و در مقایسه با عدم حضور مهارکننده (نمودار آبی) را نشان میدهد.
- مهارکننده رقابتی: شیب نمودار (
) در حضور مهارکننده رقابتی افزایش و طول از مبدا () کاهش مییابد. عرض از مبدا (
- ) تغییری نمیکند.
- مهارکننده غیررقابتی: شیب نمودار (
) تغییری نمیکند. عرض از مبدا () افزایش و طول از مبدا (
- ) مییابد.
- مهارکننده نارقابتی: شیب نمودار (
) و عرض از مبدا () افزایش مییابد اما طول از مبدا (
- ) ثابت است.
مرتبه واکنشهای آنزیمی
یکی از پارامترهایی که در بررسی سینتیک واکنشها در نظر گرفته میشود، درجه یا مرتبه واکنش است. درجه واکنش مفهومی است که بر اساس ارتباط واکنشدهندهها و محصولات با سرعت واکنش تعریف میشود.
- واکنش مرتبه صفر: در این واکنشها سرعت واکنش مستقل از غلظت واکنشدهندهها است به این معنی که افزایش یا کاهش غلظت واکنشهنده تغییری در سرعت ایجاد نمیکند.
- واکنش مرتبه یک: در این واکنشها سرعت واکنش وابسته به تغییر غلظت واکنشدهندهها است.
- واکنش مرتبه دو: در این واکنشها سرعت واکنش به مجذور غلظت واکنشدهندهها وابسته است. یا دو واکنشدهنده در واکنش شرکت دارند.
در واکنشهای آنزیمی اگر غلظت سوبسترا بسیار کمتر از
باشد، سرعت کسری از غلظت سوبسترا است و واکنش آنزیمی مرتبه اول است. شروع واکنشهای آنزیمی و اتصال سوبسترا به آنزیم، واکنش مرتبه ۱ است. اگر در این واکنشها غلظت سوبسترا بسیار از کمتر از باشد، سرعت واکنش برابر
و مرتبه واکنش آنزیمی صفر است. مرتبه واکنشهای آنزیمی در حالت تعادل و زمانی که آنزیم تنها یک سوبسترا دارد، صفر است.
عدد تغییر آنزیم چیست ؟
«عدد تغییر آنزیم» (Enzyme Turnover Number) بیشترین تعداد مولکول سوبسترا است که یک آنزیم اشباع در واحد زمان به محصول تبدیل میکند. عدد تغییر بسیاری از آنزیمها در شرایط فیزیولوژی بدن بین
واکنش در ثانیه است. در آنزیمهایی که یک جایگاه فعال دارند، عدد تغییر ثابت کاتالیست (
) نام دارد و از فرمول زیر محاسبه میشود.
چه عواملی سینتیک واکنش های آنزیمی را تغییر می دهد ؟
غلظت سوبسترا و تمایل آنزیم به سوبسترا دو عامل اصلی هستند که سرعت واکنشهای آنزیمی را تغییر می دهند. افزایش غلظت سوبسترا تا زمان اشباع شدن آنزیم سرعت واکنش را افزایش میدهد. پس از آن هر چه غلظت سوبسترا افزایش یابد در سرعت واکنش تغییری ایجاد نمیشود. از طرفی هر چه تمایل آنزیم به سوبسترا بیشتر باشد، سرعت واکنش افزایش مییابد. مهارکنندهها ازجمله مولکولهای تنظیمی هستند که با تغییر تمایل آنزیم به سوبسترا سینتیک واکنش های شیمیایی را تغییر میدهند. دو مهارکننده اصلی، سینتیک واکنش آنزیمی را تغییر میدهند.
- «مهارکنندههای برگشتناپذیر» ( Irreversible Inhibitors): این مهارکنندهها با پیوند کووالانسی به آنزیم متصل میشوند و با مسدود کردن جایگاه سوبسترا یا تغییر شکل جایگاه فعال، فعالیت آنزیم را متوقف میکنند. سیانید (
) یکی از مهارکنندههای برگشتناپذیر از که با پیوند کووالانسی به گروه آهن (
- ) موجود در سیتوکروم اکسیداز میتوکندری، از پیشرفت واکنشهای زنجیره انتقال الکترون جلوگیری میکند.
- «مهارکنندههای برگشتپذیر» (Rreversible Inhibitors): این مهارکنندهها با پیوندهای ضعیف به آنزیم متصل میشوند و سرعت واکنش آنزیمی را کاهش میدهند. این مهارکنندهها به چهار دسته تقسیم میشوند.
- «مهارکنندههای رقابتی» (Competitive Inhibitors): ساختار این مولکولها شباهت زیادی به ساختار سوبسترا دارد با این تفاوت که آنزیم اثر کاتالیکی روی آن ندارد. به همین دلیل مهارکنندههای رقابتی به جایگاه فعال آنزیم متصل میشوند و از اتصال سوبسترای اصلی به آنزیم جلوگیری میکنند. در هر لحظه یکی از دو مولکول مهارکننده رقابتی یا سوبسترا به آنزیم متصل میشوند و امکان اتصال همزمان آنها وجود ندارد. مهارکنندههای رقابتی تعداد آنزیمها در دسترس برای تبدیل سوبسترا به محصول را کاهش میدهند. اگر غلظت سوبسترا کم باشد، مهارکننده رقابتی سرعت واکنش را کاهش میدهد. اما با افزایش غلظت سوبسترا جایگاه فعال تمام آنزیمها بهوسیله سوبسترا پر میشود و جایی برای اتصال مهارکننده و تغییر سینتیک واکنش آنزیمی باقی نمیماند. بسیاری از داروهایی که عملکرد آنزیمها را تغییر میدهند از این نوع هستند.
-
- «مهارکنندههای نارقابتی» (Non-Competitive Inhibitors:): رقابتی برای اتصال این مولکولها یا سوبسترا به آنزیم وجود ندارد و اتصال مهارکننده رقابتی به جایگاه تنظیمی آنزیم از اتصال سوبسترا به جایگاه فعال جلوگیری نمیکند اما پس از اتصال مهارکننده، آنزیم نمیتواند سوبسترا را به محصول تبدیل کند. در این نوع مهار آنزیمی، افزایش سوبسترا تغییری در اتصال مهارکننده به جایگاه تنظیمی و تغییر سینتیک واکنش آنزیمی ایجاد نمیکند. اتصال این مهارکنندههای به آنزیم به شکل برگشتپذیر و غیربرگشتپذیر انجام میشود و ممکن است برای مدت کوتاهی فعالیت آنزیم را متوقف کنند.
- «مهارکنندههای غیررقابتی» (Uncompetitive Inhibitors): عملکرد این مولکولها شبیه به مهارکنندههای غیررقابتی است با این تفاوت که فقط پس از تشکیل مجموعه ES به آنزیم متصل میشوند.
- «مهارکنندههای ترکیبی» (Mixed Inhibitor): عملکرد این مهارکنندههای ترکیبی از مهارکنندههای رقابتی و غیررقابتی است. مهارکنندههای رقابتی به آنزیم آزاد و مجموعه ES متصل میشوند اما معمولا تمایل بیشتری به یکی از این حالتها دارند.
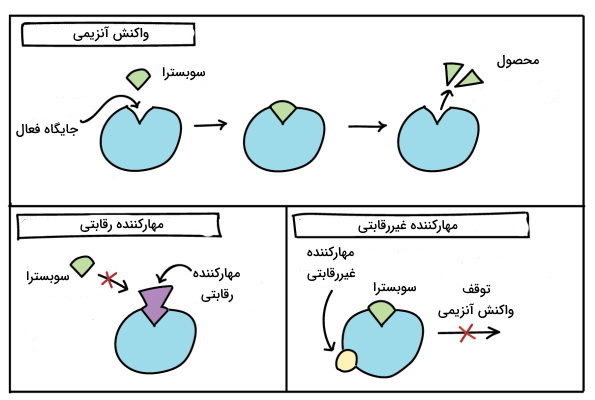
مهارکنندههای رقابتی برای اتصال به جایگاه فعال آنزیم با سوبسترا رقابت میکنند. مهارکنندههای غیررقابتی به جایگاه تنظیمی متصل میشوند و از تبدیل سوبسترا به محصول جلوگیری میکنند.
نمودار زیر نسبت تغییر سرعت واکنشهای آنزیمی با تغییر غلظت سوبسترا را در سه حالت عادی، حضور مهارکننده رقابتی و مهارکننده غیررقابتی نشان میدهد.
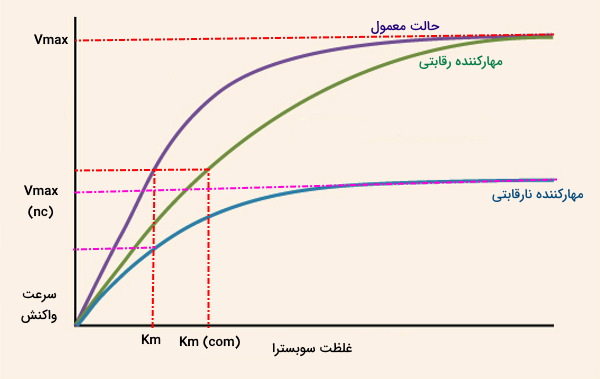
، را افزایش میدهد و مهارکننده نارقابتی بدون تغییر به جدید میرسد. حداکثر سرعت واکنش بدون حضور مهارکننده و در حضور مهارکننده رقابتی، حداکثر سرعت واکنش آنزیمی در حضور مهارکننده نارقابتی، غلظت سوبسترا در نصف سرعت حداکثری بدون حضور مهارکننده و در حضور مهارکننده نارقابتی و
- حضور مهارکننده رقابتی تمایل آنزیم به سوبسترا را کاهش میدهد و سبب میشود غلظت بیشتری از سوبسترا برای رسیدن به
آنزیم نیاز باشد. در این حالت نسبت به حالت عادی تغییری نمیکند اما افزایش مییابد. سرعت واکنش آنزیمی در حضور مهارکننده رقابتی برگشتپذیر از معادله زیر محاسبه میشود که در آن، ثابت تفکیک EI است.
-
- حضور مهارکننده نارقابتی با کاهش تعداد آنزیم در دسترس برای انجام واکنش،
واکنش آنزیمی را کاهش میدهد و افزایش غلظت سوبسترا تغییری در سرعت واکنش ایجاد نمیکند. غلظت سوبسترای لازم برای رسیدن به نصف جدید برابر با غلظت سوبسترای لازم برای رسیدن به در حالت عادی است. به همین دلیل
- واکنش با حضور مهارکننده نارقابتی تغییری نمیکند.
- مهارکنندههای غیررقابتی هر دو پارامتر
و
- را کاهش میدهند.
- مهارکنندههای ترکیبی
را کاهش میدهند اما اثر آنها بر
- وابسته به این موضوع است که به کدام حالت آنزیم (آزاد یا مجموعه ES) متصل میشوند.
اثر تغییر pH بر سینتیک واکنش های آنزیمی
اگر ساختار آنزیم و پیوندهای بین مولکولی آن با سوبسترا را در نظر بگیرید، کاملا قابل پیشبینی است که تغییر pH و پروتونه و دپروتونه شدن آمینواسیدهای جایگاه فعال، سینتیک واکنش آنزیمی را تغییر میدهد. برای درک بهتر یک واکنش آنزیمی ساده را در نظر بگیرید که pH بهینه برای فعالیت آنزیم ۷ است و سوبسترا با پیوندهای یونی به جایگاه فعال متصل میشود. در این حالت اتصال سوبسترا به آنزیم، بهراحتی از راه برهمکنش گروههای عاملی
و
در جایگاه فعال و آمینواسیدها انجام میشود.
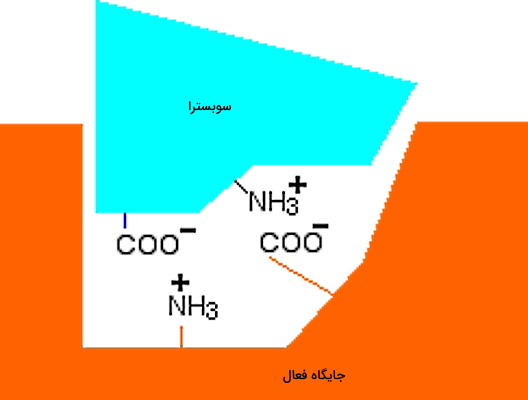
اگر pH محیط به اسیدی تغییر کند، بار
در آنزیم و سوبسترا به دلیل جذب پروتون صفر میشود. در این حالت سوبسترا نمیتواند به جایگاه فعال متصل شود. در نتیجه واکنش آنزیمی متوقف میشود. اگر pH کاهش یابد و محیط قلیایی شود چه اتفاقی میافتد؟ در این حالت بار
موجود در جایگاه فعال و سوبسترا با از دست دادن پروتون صفر میشود. در نتیجه اتصال سوبسترا به آنزیم و انجام واکنش آنزیمی متوقف خواهد شد. به علاوه تغییر pH در بازهای بسیار متفاوت از مقدار بهینه، ممکن است ساختار سوم این مولکول آنزیمی را دناتوره و فعالیت آنزیم را به شکل برگشتناپذیر متوقف کند.
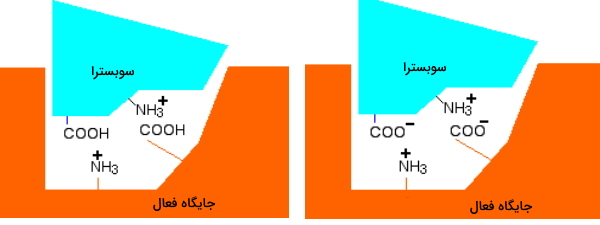
در pH اسیدی و تصویر راست دپروتونه شدن
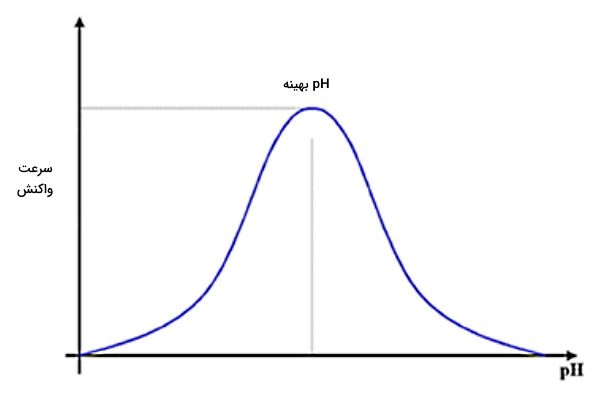
سرعت واکنش آنزیمی با تغییر pH تغییر میکند و در pH بهینه، سرعت واکنش
خواهد بود. در pH پایینتر و بالاتر از مقدار بهینه، سرعت واکنش آنزیمی پایین است.
اگر آنزیم از قوانین سینتیک میکائیلیس منتن تبعیت کند، معادله تعیین سرعت واکنش آنزیمی با توجه به تغییر pH شبیه به معادله تعیین سرعت در مهارکنندهها است. در واکنشهایی که تنها یک سوبسترا شرکت دارند، سرعت واکنش را میتوان بهوسیله معادله زیر محاسبه کرد.
در این معادله
و ثابت تفکیک اسید آنزیم، غلظت یون هیدروژن،
سرعت واکنش آنزیمی در pH بهینه و k سرعت در هر لحظه از واکنش را نشان میدهد.
اثر دما بر سینتیک واکنش های آنزیمی
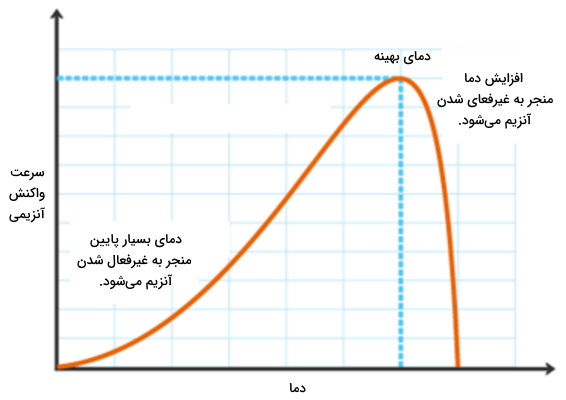
افزایش دما، با افزایش انرژی جنبشی مولکولها سوبسترا و افزایش احتمال برخورد سوبسترا با آنزیم و تامین انرژی فعالسازی، سرعت واکنش آنزیمی را افزایش میدهد. این افزایش سرعت تا نقطه بهینه ادامه مییابد. به خاطر بیاورید که آنزیمها کاتالیستهای پروتئینی هستند که افزایش دمای زیاد مانند سایر پروتئینها ساختار سوم آنها در دمای بسیار بالا دناتوره میشود و آنزیم فعالیت خود را دست میدهد. به همین دلیل سرعت واکنش آنزیمی کاهش مییابد. دمای بهینه (Optimum Temperature |
) آنزیمهای بدن انسان ۳۷ درجهسانتیگراد است.
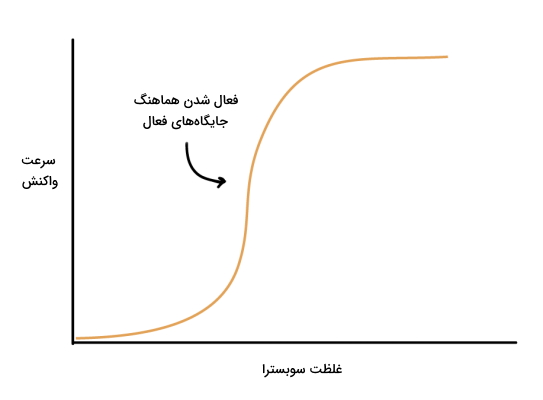
سینتیک آنزیم های آلوستریک
آنزیمهای آلوستریک پروتئینهایی چند زیرواحدی با ساختار چهارم هستند که بر خلاف آنزیمهای میکائیلیس منتن، با چند جایگاه فعال دارند که معمولا وابسته به هم و «تعاملی» (Cooperative) فعالیت میکنند. در این آنزیمها، فعال شدن یک جایگاه فعال سبب تغییر کنفورماسیون جایگاه دیگر و فعال شدن آن میشود. به علاوه مولکولهای فعالکننده و مهارکننده فعالیت این آنزیمها را تنظیم میکنند. اتصال مهارکننده به یکی از جایگاههای تنظیمی فعالیت تمام جایگاههای فعال را کاهش میدهد و اتصال یک فعالکننده به جایگاه تنظیمی، جایگاههای فعال دیگر را نیز برای شروع واکنش آماده میکند. در نتیجه این آنزیمها دو حالت فعال (R-state) و غیرفعال (T-state) دارند. زمانی که غلظت سوبسترا زیاد باشد آنزیم در حال R و زمانیکه غلظت سوبسترا کم باشد، آنزیم در حالت T قرار میگیرد.
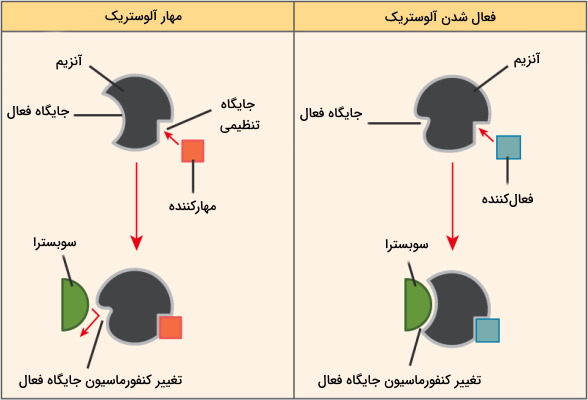
از آنجایی که جایگاه فعال آنزیمهای آلوستریک به هم وابسته است و فعال شدن یک جایگاه، فعال شدن سایر جایگاههای فعال را به دنبال خواهد داشت، این آنزیم ها به تغییر غلظت سوبسترا احساستر هستند. منحنی سرعت این آنزیمها بر اساس تغییر غلظت سوبسترا برخلاف آنزیمهای میکائیلیس سیگموئید یا S شکل است و کمترین تغییر غلظت سوبسترا، سرعت را افزایش میدهد. این منحی از سه بخش تشکیل میشود.
- مرحله اول: در این مرحله سرعت واکنش به دلیل افزایش غلظت سوبسترا، با شیب تند افزایش مییابد.
- مرحله دوم: در این مرحله رابطه سرعت واکنش با غلظت سوبسترا خطی است و سوبسترای بیشتری در دسترس آنزیم قرار دارد. در این مرحله با افزایش غلظت سوبسترا تعداد جایگاههای فعال R-state افزایش مییابد.
- مرحله سوم: در این مرحله آنزیم اشباع میشود و تغیییر غلظت سوبسترا اثری بر سرعت واکنش ندارد.
معادله هیل
برای بررسی سینتیک واکنش آنزیمهای آلوستریک از معادله هیل استفاده میشود. معادله زیر رابطه بین پارامترهای مختلف در بررسی سرعت واکنش آنزیمهای آلوستریک بهوسیله معادله هیل را نشان میدهد.
- V: سرعت واکنش در واحد زمان را نشان میدهد.
- : حداکثر سرعتی است که یک آنزیم سوبسترا را به محصول تبدیل میکند.
- : غلظت سوبسترا که با واحدهای مختلف مول، میلیمول، میکرومول، پیکومول، نانوگرم بر میلیلیتر یا درصد بیان میشود.
- : اگر ثابت هیل یک در نظر گرفته شود، همان ثابت میکائیلیس است.
: ثابت هیل است و مثل سایر ثابتها واحد ندارد. مقدار عددی تعامل سوبسترا با آنزیم را فراهم میکند و با سه مقدار بیان میشود.
- : مقدار n بیشتر از ۱، نشاندهنده تنظیم آلوستریک و تعاملیی مثبت است. در این حالت اتصال سوبسترا یا لیگاند به آنزیم سبب فعال شدن جایگاههای فعال دیگر و فعالیت بیشتر آنزیم میشود.
- : مقدار n برابر ۱ نشان میدهد آنزیم از سینتیک میکائیلیس منتن پیروی میکند. در این حالت ممکن است آنزیم یک جایگاه فعال یا چند جایگاه فعالی داشته باشد که با هم مرتبط نیستند.
-
- : اگر مقدار ثابت هیل کمتر از ۱ باشد، نشان میدهند که اتصال سوبسترا به آنزیم «تعامل منفی» (Negative Cooperativity) دارد و منجر به غیرفعال شدن سایر جایگاههای فعال میشود.
بررسی سینتیک واکنش آنزیمی در آزمایشگاه
ویژگیهای مختلف آنزیمها و حضور آنها در یک محلول یا نمونه را میتوان با استفاده از روشهای «ارزیابی آنزیمی» (Enzyme assays) بررسی کرد. در این روشها از طیفسنجی، نشر فلوئورسنت یا «رنگسنجیهای مختلف» (Colorimetry) برای بررسی غلظت سوبسترا یا محصول بهره برده میشود. برای مقایسه عملکرد دو آنزیم مختلف تمام شرایط جانبی ازجمله pH، دما و بافرهای مصرفی یکسان باشد و شرایط فیزیولوژیک بهینه برای آنها در نظر گرفته شود.
مثالهای محاسبه پارامترهای سینتیک واکنش آنزیمی
برای اینکه سینتیک واکنشهای آنزیمی را بهتر متوجه شویم، در این بخش چند نمونه از تمرینهای این مبحث را با هم حل میکنیم.
۱- واکنش بین نیکوتین آمیدمونونوکلئوتید (NMN) و ATP برای تشکیل نیکوتین آمید-آدنین دینوکلئوتید (NAD) و دیروفسفات بهوسیله آنزیم نیکوتینآمید مونونوکلئوتید آدنیل ترانسفراز کاتالیز میشود. در جدول زیر پارامترهای کاتالیزی این آنزیم در pH = ۴٫۹۵ بیان شده است. [S] غلظت سوبسترا و V مقدار NAD تشکیل شده در بازه ۳ دقیقهای را نشان میدهد.
و
را محاسبه کنید.
| (mM) [S] |
| (mM) [S] | |||
| ۰٫۳۲۴ | ۰٫۵۶۰ | ۰٫۱۴۸ | ۰٫۱۳۸ |
| ۰٫۳۹۰ | ۰٫۷۶۶ | ۰٫۱۷۱ | ۰٫۲۲۰ |
| ۰٫۴۹۳ | ۱٫۴۶۰ | ۰٫۲۳۴ | ۰٫۲۹۱ |
مقدار
را میتوان با رسم نمودار لینور-برک و شیب خط این نمودار محاسبه کرد. در این نمودار شیب خط و عرض از مبدا است. در نتیجه مقدار و
به روش زیر محاسبه میشود.
شیب خط =
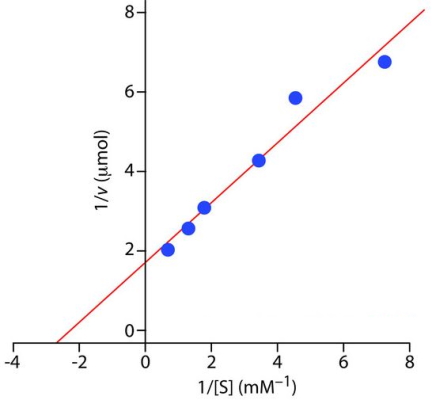
و
۲- آنزیم X از سینتیک میکائیلیس منتن تبعیت میکند. این آنزیم
از سوبسترا را با سرعت اولیه هیدرولیز میکند و این واکنش آنزیمی است.
واکنش را محاسبه کنید.
نکته: دقت کنید،
مقدار عددی ثابت است و واحد ندارد.
۳- آنزیم اورآز
اوره را با = و سرعت اولیه هیدرولیز میکند.
این واکنش آنزیمی را محاسبه کنید. (اورآز در این واکنش از سینتیک میکائیلیس منتن تبعیت میکند.)
۴- آنزیمی با
سوبسترایی با غلظت را تجزیه میکند. اگر سرعت اولیه واکنش باشد، غلظت سوبسترایی که سرعت اولیه
دارد را محاسبه کنید.
۴- آنزیم اورهآز با
و ، اوره را با سرعت اولیه هیدرولیز میکند. اگر
واکنش با چه سرعت اولیهای شروع خواهد شد؟
سوالات متداول
در این بخشی تعدادی از سوالات پرتکرار پیرامون سینتیک واکنش آنزیمی را پاسخ میدهیم.
چرا بررسی سینتیک واکنش آنزیمی مهم است ؟
بررسی سینتیک واکنش آنزیمی توضیح میدهد، آنزیم چگونه کار میکند و امکان پیشبینی فعالیت آنزیمی در بدن موجود زنده را فراهم میکند. پیشبینی رفتار آنزیم به طراحی داروهایی کنترلکننده مسیرهای متابولیسمی (مهارکنندهها یا فعالکنندهها)، کمک فراوانی میکند.
چه عواملی بر سرعت واکنش آنزیمی اثر دارد ؟
عواملی که بر سرعت واکنش آنزیمی اثر میگذارند به دو دسته محیطی و ویژگیهای آنزیم تقسیم میشوند. غلظت سوبسترا، دما، pH، مهارکنندهها و فعالکنندهها عوامل محیطی موثر بر سرعت واکنش آنزیمی هستند. غلظت آنزیم و تمایل آنزیم به سوبسترا ویژگیهای آنزیمی موثر بر سینتیک واکنش هستند.
Vmax و Km در بررسی سینتیک واکنشهای آنزیمی چیست ؟
Vmax حداکثر سرعتی است که یک آنزیم میتواند سوبسترا را به محصول تبدیل کند و Km غلظتی از سوبسترا است که در آن نقطه، سرعت واکنش آنزیمی نصف حداکثر سرعت آنزیم است (v=Vmax/۲).