آرایش الکترونی عناصر نحوه توزیع الکترونها را در لایهها و زیرلایههای الکترونی نشان میدهد و برای توصیف اوربیتالها در حالت پایه مورد استفاده قرار میگیرد. البته آرایش الکترونی برای نشان دادن تبدیل یک اتم به یون از طریق از دست دادن یا دریافت الکترون نیز کاربرد دارد. بسیاری از خواص فیزیکی و شیمیایی عناصر به آرایش الکترونی منحصر به فرد آنها مرتبط است. همچنین الکترونهای ظرفیت – الکترونهای بیرونیترین لایه – که تعداد آنها از طریق آرایش الکترونی مشخص میشود تعیینکننده شیمی عناصر هستند. در این مطلب به زبانی ساده به بررسی آرایش الکترونی عناصر میپردازیم و نحوه رسم برخی از عناصر را در جدول تناوبی با ذکر مثال توضیح میدهیم. همچنین در این مطلب اوربیتالها و ۴ عدد کوانتومی را معرفی کرده و توضیح دادهایم.
آرایش الکترونی عناصر جدول تناوبی
قبل از تقسیمبندی کردن الکترونها در اوربیتالها باید با مفهوم آرایش الکترونی عناصر آشنا شد. هر عنصر موجود در جدول تناوبی از اتم تشکیل شده و هر اتم شامل سه ذره پروتون، نوترون و الکترون است. الکترون ذرهایی با بار الکتریکی منفی است که در اطراف هسته (بار مثبت) در اوربیتالها یافت میشود. به عبارتی میتوان گفت که اوربیتال حجم فضایی بوده که بیشترین احتمال (۹۵٪) حضور الکترون را دارد.
اوربیتالها به ۴ نوع تقسیم میشوند و هر یک از این اوربیتالها شکلهای مختلفی دارند. این ۴ نوع اوربیتال عبارتند از:
- اوربیتال s
- اوربیتال p
- اوربیتال d
- اوربیتال f
همانطور که در بالا اشاره شد آرایش الکترونی هر عنصر بسته به موقعیت آن در جدول تناوبی منحصر به فرد و با عنصر دیگری متفاوت است. دوره و تعداد الکترونها که توسط عدداتمی مشخص میشود تعیین کننده سطح انرژی هستند که الکترونها در آنها قرار میگیرند. اوربیتالهایی با سطوح انرژی متفاوت، همانند هم هستند اما با این تفاوت که هر کدام از این اوربیتالها ناحیههای خاصی را در فضا اشغال میکنند.
به عنوان مثال اوربیتالهای
و هر دو مشخصههای اوربیتال
را دارند (گرههای شعاعی، حجم کروی و حضور تنها دو الکترون در اوربیتال). اما هر یک از این دو اوربیتال به دلیل تفاوت در سطوح انرژی فضاهای متفاوتی را در اطراف هسته اشغال میکنند. در جدول تناوبی همانطور که در تصویر زیر نشان داده شده عناصر به یکی از چهار بلوک s، p، d و f تقسیمبندی میشوند.
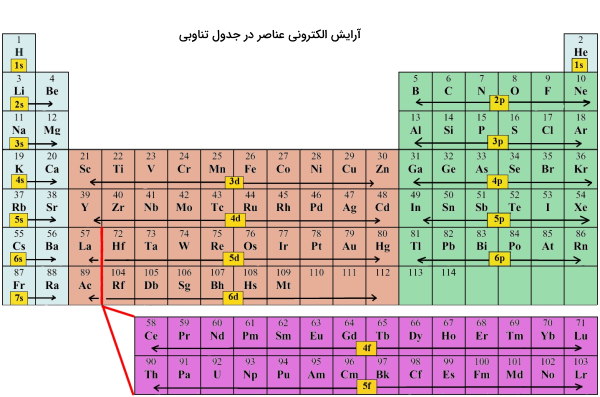
طبق تصویر فوق فلزات قلیایی، قلیایی خاکی و هلیم در بلوک
قرار میگیرند. به همین ترتیب عناصر واسطه داخلی (گروه ۳ تا ۱۲) در دسته عناصر بلوک ، گروه ۱۳ تا ۱۸ در دسته عناصر بلوک و لانتانیدها و آکتنیدها در دسته عناصری با بلوک
قرار میگیرند.
استفاده از جدول تناوبی کلید اصلی برای رسم آرایش الکترونی عناصر است به گونهای که یک ابزار کمکی بسیار مهم برای نوشتن آرایش الکترونی به حساب میآید. البته این موضوع را به خاطر بسپارید که برای اینکار قوانین و اصولی وجود دارد که به آنها در ادامه میپردازیم اما قبل از پرداختن به این قوانین هر کدام از ۴ نوع اوربیتالها را که در قسمت قبلی به آنها اشاره کردیم به اختصار معرفی میکنیم.
۱. اوربیتال s
اوربیتال
اوربیتال کرویشکل بوده که به صورت متقارن در اطراف هسته اتم قرار میگیرد. این اوربیتال همانند یک توپ خالی است که در درون آن هسته وجود دارد و با افزایش سطوح انرژی، اوربیتالها دورتر از هسته قرار میگیرند به عبارتی اوربیتالها بزرگتر میشوند. ترتیب قرارگیری اوربیتالها بر اساس اندازه در تصویر زیر نشان داده شده است.
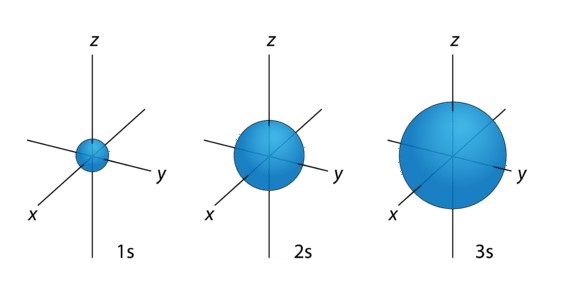
همانطور که در تصویر مشاهده میشود اوربیتالها بزرگتر شدهاند. تعداد الکترون در هر اوربیتال با استفاده از رابطه زیر محاسبه میشود:
در رابطه فوق
یکی از چهار عدد کوانتومی است که تعداد و شکل اوربیتالها را نشان میدهد و مقدار آن برای اوربیتال s برابر صفر است. بدین ترتیب با جایگزینی مقدار صفر در رابطه فوق بیشترین تعداد الکترون که مجاز هستند در اوربیتال
قرار بگیرند برابر ۲ خواهد بود.
۲. اوربیتال
توجه داشته باشید که همه عناصر، اوربیتال
را در آرایش الکترونی خود دارند زیرا در اولین سطح از انرژی، تنها اوربیتال وجود دارد. سپس در دومین سطح انرژی علاوه بر اوربیتال اوربیتال نیز وجود دارد. شکل اوربیتال مطابق تصویر زیر به صورت دمبل است. در این حالت
آن یک خواهد بود و ۶ الکترون بیشترین تعداد الکترون مجازی است که میتوانند در این اوربیتال قرار بگیرند.
اوربیتال
با توجه به جهتگیری در راستای x، y و z دارای ۳ جهت px، py و pz است. جهتگیریهای اوربیتالها را با نشان میدهند و مقادیر آن شامل تا میشود. تصویر زیر مربوط به اوربیتال
و جهتگیریهای آن است.
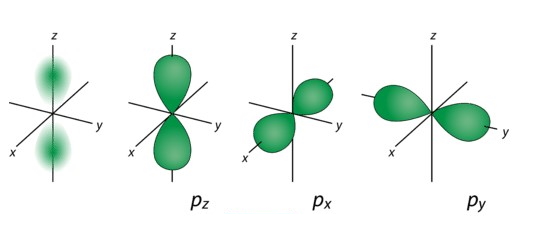
۳٫ اوربیتال
علاوه بر اوربیتالهای
و در سطوح انرژی بالاتر دو نوع اوربیتال دیگر نیز وجود دارد. در سطح انرژی سوم علاوه بر و اوربیتال نیز وجود دارد و براساس سه مولفه برداری به پنج صورت جهتگیری میتواند داشته باشد (مقادیر
برابر ۲-، ۱-، ۰، ۱ و ۲ است.). این جهتها عبارتند از:
در اوربیتال
مقدار برابر ۴ است پس ۱۰ الکترون بیشترین تعداد الکترونی هستند که میتوانند در این اوربیتال وجود داشته باشند. در تصویر زیر ۵ جهتگیری اوربیتال
نشان داده شده است.
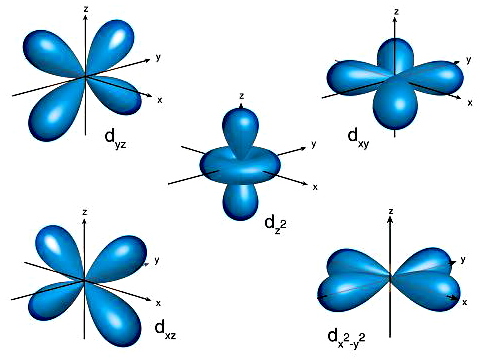
۴. اوربیتال
در این نوع اوربیتال ۷ اوربیتال با جهتگیری و شکلهای مختلف وجود دارد که در تصویر زیر نشان داده شدهاند. همچنین ۱۴ الکترون بیشترین تعداد الکترونی است که میتوانند در این اوربیتال وجود داشته باشند.
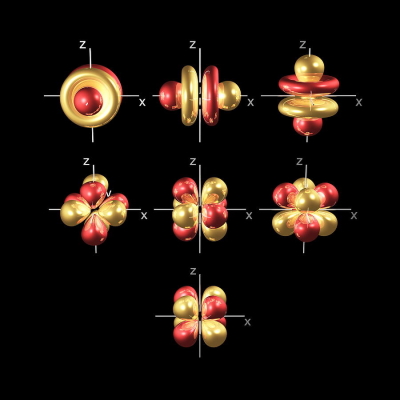
نکته: توجه داشته باشید که برای نشان دادن الکترونهای اوربیتال ۴ عدد کوانتومی وجود دارد که تا این قسمت ۳ عدد کوانتومی
را معرفی کردیم. همانطور که اشاره شد این اعداد به ترتیب شماره لایه، شکل و جهتگیری اوربیتال را نشان میدهند.
آخرین عدد کوانتومی مربوط به حرکت اسپین الکترونها در اوربیتالهاست که ساعتگرد یا پادساعتگرد بودن جهت آنها را نشان میدهد و نماد آن به صورت
است. اگر اسپین رو به بالا یا رو به پایین باشد مقادیر این عدد کوانتومی به ترتیب برابر با یا
خواهد بود.
در ادامه به معرفی قوانین آرایش الکترونی عناصر میپردازیم.
پر کردن اوربیتالها
الکترونها به گونهای اوربیتالها را پر میکنند که انرژی اتم را به حداقل برسانند. بنابراین الکترونها بر اساس مقدار سطح از انرژی از هسته دور و یا به آن نزدیک هستد، به عنوان مثال هرچه سطح انرژی الکترون بیشتر باشد از هسته دورتر میشود. ترتیب پرکردن الکترونها در لایهها به صورت زیر خواهد بود:
برای اینکه ترتیب بالا را بهتوان به شیوهای ساده و درست به ذهنمان بسپریم میتوان از الگویی که در تصویر زیر نشان داده شده کمک گرفت.

اصل طرد پائولی
اصل طرد پائولی بیان میکند که هیچ دو الکترونی با چهار عدد کوانتومی یکسان نمیتواند در اوربیتال حضور داشته باشد. ۳ عدد کوانتومی اول احتمال دارند که به هم شباهت داشته باشند اما قطعا چهارمین عدد کوانتومی متفاوت خواهد بود. هر اوربیتال میتواند ماکزیمم دو الکترون را با اسپینهای متفاوت در خود جای دهد. همانطور که در قسمت های قبلی اشاره کردیم زیرلایههای d، p، s و f به ترتیب ۱، ۳، ۵ و ۷ اوربیتال دارند.
قانون هاند
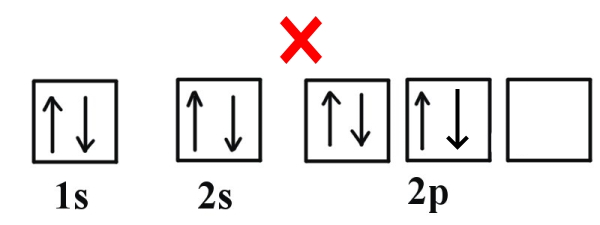
زمانیکه الکترونها در اوربیتالها قرار میگیرند هر الکترون در ابتدا همه اوربیتالها را با انرژی یکسان پر میکند و بعد از آن در اوربیتال الکترونهای با اسپین مخالف قرار میگیرند. به عنوان مثال به تصویر زیر نگاه کنید حالت اول اشتباه میباشد زیر در هر اوربیتال دو الکترون با اسپینهای متفاوت قرار گرفتهاند و آخرین اوربیتال خالی است. در حالیکه در ابتدا باید در هر اوربیتال الکترون با اسپین رو به بالا قرار بگیرد و در نهایت اوربیتالها توسط الکترونهایی با اسپین رو به پایین مجددا پر شوند.
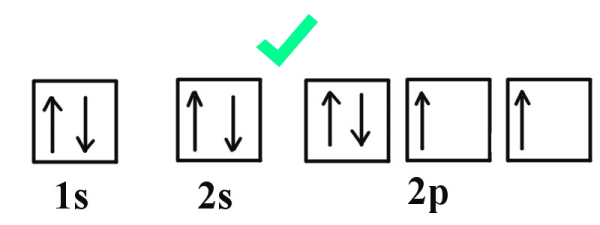
تصویر فوق مربوط به آرایش اوربیتالهای اتم اکسیژن با عدد اتمی ۸ است. طبق قانون هاند در ابتدا باید ۵ الکترون ۵ اوربیتال را با اسپینهای رو به بالا پر میکنند و در نهایت ۳ الکترون باقیمانده مجددا از اوربیتال اول ( این بار با اسپینهای رو به پایین) شروع به پر کردن اوربیتالها میکنند.
اصل آفبا
آفبا از کلمه آلمانی (Aufbauen) به معنای «ساختن» یا بنا کردن مشتق گرفته شده است. برای آرایش الکترونی یک اتم، اوربیتالها باید بر اساس افزایش سطح انرژی و بنا به افزایش عدد اتمی پر شوند که این اصل، اصل آفبا نام دارد. البته در این مورد استثناء هم وجود دارد که در قسمتهای بعدی به طور مفصل به این موضوع میپردازیم.
مثال برای نوشتن آرایش الکترونی عناصر
تا این قسمت از مطلب در مورد مفهوم اوربیتال، انواع آن، ترتیب پر شدن زیرلایهها، قوانین و اصولی که برای این کار وجود دارد را با هم بررسی و مرور کردیم.
از کنار هم قرار دادن این موضوعات میتوان آرایش الکترونی مربوط به عناصر را رسم کرد. برای اینکار حتما باید عدد اتمی عناصر را داشته باشیم.
مثال ۱
آرایش الکترونی عناصر زیر را بنویسید:
مثال ۲
نحوه آرایش الکترونها را در اوربیتالهای مربوط به عنصر نیتروژن (عدد اتمی ۷) و اکسیژن (عدد اتمی ۸) نشان دهید.
حل: در ابتدا بهتر است که آرایش الکترونی مربوط به هر عنصر را رسم کنیم تا بتوان مشاهده کرد که اتمهای اکسیژن و هیدروژن چند اوربیتال و هر اوربیتال چند الکترون دارد.
آرایش الکترونی اکسیژن به صورت
و نیتروژن به صورت
است.
از آرایش الکترونی هر عنصر میتوان متوجه شد که هر دوی آنها دو لایه دارند. بنابراین در یک لایه اوربیتال مربوط به s و در لایه دیگری دو اوربیتال مربوط به s و p وجود دارند.
پس با توجه به نحوه آرایش الکترونهای عنصر نیتروژن نحوه قرارگیری الکترونها در اوربیتالها به صورت زیر است:
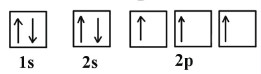
و آرایش الکترونی اکسیژن در اوربیتالها به صورت زیر خواهد بود:
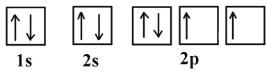
آرایش الکترونی گازهای نجیب
گازهای نجیب، گازهای خنثی یا گازهای بیاثر همگی به گازهای گروه ۱۸ جدول تناوبی اشاره دارند که آرایش الکترونی آنها پایدار است. زیرا در لایه ظرفیت این گازها ۸ الکترون وجود دارد یعنی در هر دو اوربیتال s و p حداکثر مقدار الکترون وجود دارد پس آرایش الکترونی آنها پایدار است. به همین دلیل این گازها تمایل به واکنشپذیری ندارند از این رو به آنها گازهای بیاثر یا خنثی میگویند. در این عناصر آرایش الکترونی به گونهای است که اوربیتالهای s دارای ۲ الکترون و اوربیتالهای p دارای ۶ الکترون هستند. گازهای نجیب شامل عناصر زیر هستند:
- هلیم (عدد اتمی برابر ۲)
- نئون (عدد اتمی برابر ۱۰)
- آرگون (عدد اتمی برابر ۱۸)
- کریپتون (عدد اتمی برابر ۳۶)
- زنون (عدد اتمی برابر ۵۴)
آرایش الکترونی هر یک از عناصر فوق به ترتیب به صورت زیر است:
آرایش الکترونی فشرده عناصر
آرایش الکترونی عناصر را میتوان بر اساس آرایش الکترونی گازهای نجیب نوشت. به این صورت که اگر تعداد الکترونهای عنصری مانند کلسیم برابر ۲۰ باشد میتوان جای ۱۸ الکترون، نماد گاز آرگون (با ۱۸ الکترون) را بگذاریم و در ادامه آرایش الکترونی ۲ الکترون را به همان شیوه قبل ادامه دهیم. به این نوع آرایش الکترونی، آرایش الکترونی فشرده عناصر میگویند.
نکته: برای انتخاب گاز نجیب مورد نظر باید گازی را انتخاب کنید که عدد اتمی آن پایینتر از عنصر مورد نظر باشد. به عنوان مثال همان عنصر کلسیم را در نظر بگیرید عدد اتمی آن ۲۰ است دو گاز نجیب قبل و بعد آن یعنی آرگون و کریپتون وجود دارد که باید گاز قبل از آن را یعنی آرگون را انتخاب کنید.
به عنوان مثال میتوان آرایش الکترونی عناصر زیر را به صورت فشرده نوشت:
آرایش الکترونی ساده وانادیم به صورت زیر است:
همان طور که در آرایش الکترونی فوق مشخص است به جای تعداد ۱۸ الکترون عنصر آرگون را قرار میدهیم و در ادامه ۲۳ که عدد اتمی عنصر وانادیم است را از ۱۸ کم میکنیم که برابر ۵ الکترون خواهد شد که آرایش الکترونی این ۵ الکترون را ادامه میدهیم. از آرایش الکترونی فشرده برای محاسبه و نشان دادن الکترونهای ظرفیت نیز استفاده میشود.
در ادامه مثالهای بیشتری را از آرایش الکترونی فشرده عناصر میبینیم:
آرایش الکترونی یون ها
طبق قانون اکتت همه عناصر برای رسیدن به آرایش الکترونی پایدار دو حالت دارند:
- الکترون از دست میدهند که این حالت اغلب برای فلزات رخ میدهد مانند آلومینیوم.
- الکترون دریافت میکنند و این حالت اغلب برای نافلزات رخ میدهد مانند کلر.
زمانی که اتمها الکترون از دست بدهند بار الکتریکی یون باردار، مثبت و زمانیکه الکترون دریافت کنند بار الکتریکی ذره منفی میشود. در این صورت بر حسب اینکه اتم مورد نظر برای تبدیل به یون چند الکترون از دست داده یا دریافت کرده از عدد اتمی مربوطه به ترتیب اضافه یا کم میکنیم. سپس براساس نکاتی که در قسمت های قبلی ذکر کردیم آرایش الکترونی را به صورت معمولی یا فشرده مینویسیم.
در این قسمت آرایش الکترونی برخی از یونها آمده که به صورت زیر هستند:
طبق آرایش الکترونی عنصر سدیم برای اینکه به آرایش پایدار برسد باید ۱ الکترون از دست بدهد که به یون
تبدیل شود. بنابراین عدد اتمی سدیم از ۱۱ به ۱۰ تغییر میکند. حال فرض کنید که در حال نوشتن آرایش الکترون عنصری هستید که عدد اتمی آن برابر ۱۰ است پس آرایش الکترونی یون سدیم به صورت زیر خواهد بود:
با مقایسه دو آرایش الکترونی فوق میتوان متوجه شد که در آرایش الکترونی دومی یک الکترون در اوربیتال s لایه سوم از دست رفته و آرایش الکترونی مربوط به گاز نجیب نئون با عدد اتمی ۱۰ شباهت دارد. آرایش اوربیتالی سدیم و یون آن نیز در تصویر زیر آورده شده است.
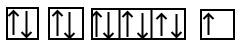
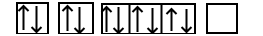
عنصر سدیم به گروه یک جدول تناوبی تعلق دارد که کاتیون آن یک بار مثبت است، بار کاتیونهای این گروه همگی یک بار مثبت هستند.
آرایش الکترونی فسفر نیز به صورت زیر است:
زمانی که این عنصر به یون تبدیل میشود سه الکترون دریافت میکند و به آنیون
تبدیل میشود که آرایش الکترونی آن به صورت زیر در میآید:
بنابراین آرایش الکترونی آنیون فسفید به گاز آرگون شباهت دارد.
آرایش الکترونی عناصر استثناء
همانطور که اشاره کردیم آرایش الکترونی برخی از عناصر جدول تناوبی مانند سایر عناصر از اصل آفبا مانند پیروی نمیکنند. اغلب این عناصر، عناصر واسطه یا فلزات سنگین هستند. دلیل این امر رسیدن به آرایش پایدار و نیمه پایدار در این عناصر است. در ابتدا به آرایش الکترونی عناصر واسطه میپردازیم و در ادامه آرایش به مبحث آرایش الکترونی عناصر استثناء برمیگردیم.
رسم آرایش الکترونی عناصر واسطه داخلی
فلزات واسطه عناصر گروه ۳ تا ۱۸ را به خود اختصاص میدهند و شامل عناصری ازجمله آهن، وانادیم، روی، اوگانسون، زیرکونیوم و غیره هستند. آرایش الکترونی این عناصر به d ختم میشود و به همین دلیل این عناصر در دسته عناصر با بلوک d قرار میگیرند. آرایش الکترونی این عناصر نام برده شده از فلزات واسطه در ادامه آورده شدهاند:
آرایش الکترونی آهن
آهن عنصری با عدد اتمی ۲۶ بوده و متعلق به گروه ۸ و دوره ۳ جدول تناوبی است که آرایش الکترونی آن را میتوان به صورت زیر نوشت:
آرایش الکترونی اوسمیم
اوسمیم با عدد اتمی ۷۶ نیز همانند آهن در گروه ۸ اما در دوره ششم جدول تناوبی قرار دارد که آرایش الکترونی آن در زیر آورده شده است:
تصویر زیر دیاگرام اوربیتالی اتم اسمیم را نشان میدهد.
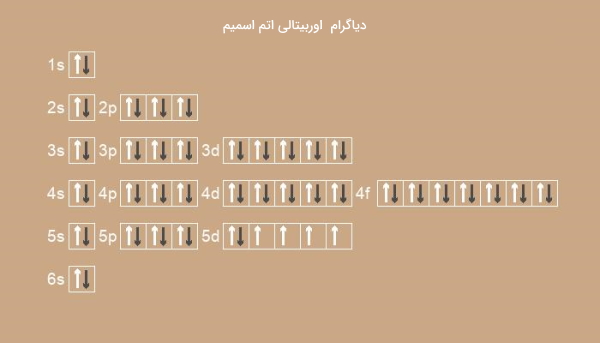
آرایش الکترونی زیرکونیوم
فلز زیرکونیوم در گروه ۴ و دوره ۵ قرار دارد که آرایش الکترونی آن به صورت زیر نمایش داده میشود:
تا این قسمت به نحوه نوشتن آرایش الکترونی برخی از عناصر واسطه پرداختیم. آرایش الکترونی سایر عناصر جز مواردی که در ادامه به آنها میپردازیم مانند همین سه مثال است.
اکنون سراغ عناصری میرویم که آرایش الکترونی آنها مانند سایر عناصر نیست و آنها را با عنوان عناصر استثناء میشناسند. در جدول زیر آرایش الکترونی عناصر استثناء به ۴ دوره (دوره ۴ تا ۷) تقسیم شده که در زیر آوره شده است.
| عنصر | آرایش الکترونی |
برای اینکه با آرایش الکترونی فشرده عناصر نیز آشنا شوید آرایش الکترونی عناصر دوره چهارم و عناصر گروه ۱ تا ۳۶ نیز در ادامه آورده شدهاند.
رسم آرایش الکترونی عناصر دوره ۴
در جدول تناوبی در دوره چهارم ۱۸ عنصر وجود دارد که آرایش الکترونی آنها به صورت فشرده در جدول زیر گرداوری شده است.
| آرایش الکترونی فشرده | عدد اتمی | عنصر |
| ۱۹ | K | |
| ۲۰ | Ca | |
| ۲۱ | Cs | |
| ۲۲ | Ti | |
| ۲۳ | V | |
| ۲۴ | Cr | |
| ۲۵ | Mn | |
| ۲۶ | Fe | |
| ۲۷ | Co | |
| ۲۸ | Ni | |
| ۲۹ | Cu | |
| ۳۰ | Zn | |
| ۳۱ | Ga | |
| ۳۲ | Ge | |
| ۳۳ | As | |
| ۳۴ | Se | |
| ۳۵ | Br | |
| ۳۶ | kr |
آرایش الکترونی عناصر ۱ تا ۳۶
عناصر ۱ تا ۳۶ معمولا عناصری هستند که بیشتر با آنها سر و کار داریم که از این میان آرایش الکترونی عناصر ۱۹ تا ۳۶ را در جدول بالا به صورت فشرده نوشتیم. بنابراین در جدول زیر آرایش الکترونی فشرده عناصر ۱ تا ۱۸ را فهرست کردهایم.
| آرایش الکترونی فشرده | عدد اتمی | عنصر |
| ۱ | H | |
| ۲ | He | |
| ۳ | li | |
| ۴ | Be | |
| ۵ | B | |
| ۶ | C | |
| ۷ | N | |
| ۸ | O | |
| ۹ | F | |
| ۱۰ | Ne | |
| ۱۱ | Na | |
| ۱۲ | Mg | |
| ۱۳ | Al | |
| ۱۴ | Si | |
| ۱۵ | P | |
| ۱۶ | S | |
| ۱۷ | Cl | |
| ۱۸ | Ar |
سادهترین روش برای رسم آرایش الکترونی عناصر
برای آرایش الکترونی عناصر یک روش بسیار ساده وجود دارد که با کمک از جدول تناوبی امکانپذیر است به همین دلیل تنها در صورتی میتوان از این روش استفاده کرد که جدول تناوبی را در اختیار داشته باشیم. این روش به این صورت است که در ابتدا عناصر جدول تناوبی را مانند تصویر زیر به بلوکهای مربوطه تقسیمبندی میکنیم و از آنجا که تعداد لایهها برابر با شماره دوره است در کنار هر دوره شماره مربوط به هر عنصر را مینویسیم. سپس عنصر مربوطه را انتخاب میکنیم و عنصرهای ماقبل آن را براساس بلوک و شماره لایه مینویسیم. همچنین برای این کار هر خانه در جدول تناوبی را به صورت یک الکترون در نظر میگیریم.
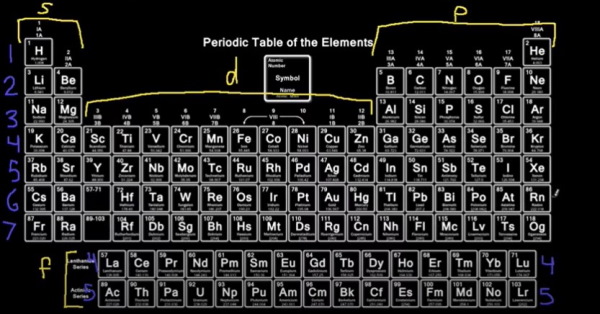
نکته: ممکن است برایتان سوال پیش آید که چرا در کنار عناصر گروه لانتانیدها و آکتنیدها شماره دورهها برابر با ۴ و ۵ نوشته شده است در حالیکه میدانیم این عناصر متعلق به دورههای ۶ و ۷ هستند. دلیل این امر آن است که شمارههایی که در تصویر بالا مشاهده میکنید مربوط به لایه ظرفیت در آرایش الکترونی عناصر است که به آن ختم میشوند. به این صورت برای بلوکهای d، p، s و f شمره لایه ظرفیت به صورت زیر خواهد بود:
بنابراین به همین خاطر با توجه فرمول شماره ۴، شماره لایههای دوره ۶ و ۷ در جدول تناوبی برابر با ۴ و ۵ هستند.
به عنوان مثال عنصر سدیم را در نظر بگیرید:
از آنجا که عدد اتمی این عنصر برابر ۱۱ است پس قبل از آن ۱۰ عنصر یا همان ۱۰ الکترون وجود دارد. طبق تصویر زیر دوره اول دو عنصر (دو الکترون) وجود دارد توجه کنید که عنصر هلیم به بلوک s ختم میشود پس تا اینجا داریم
، در دوره دوم برای بلوک s دو الکترون (لیتیم و بریلیم) و در گروههای مربوط به بلوک p، شش الکترون (عناصر بور تا نئون) وجود دارد بنابراین آرایش الکترونی آن تا اینجا به صورت است. در نهایت خود عنصر سدیم به عنوان یک الکترون در دوره سه یعنی لایه سوم در نظر گرفته میشود. پس در این قسمت آرایش الکترونی نیز به صورت
خواهد بود.
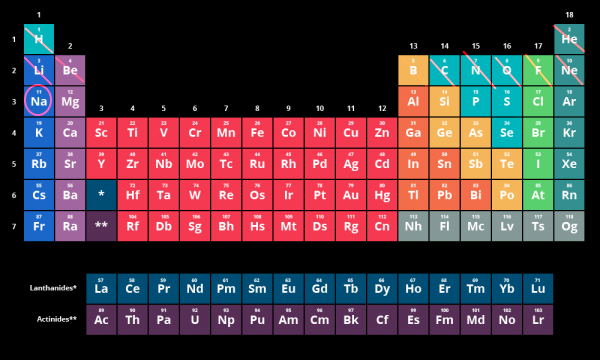
از کنار هم قرار دادن این ۳ آرایش الکترونی در کنار هم آرایش الکترونی عنصر سدیم در نهایت به صورت زیر خواهد بود:
عنصر گوگرد را نیز در نظر بگیرید.
حل: عدد اتمی این عنصر برابر ۱۶ بوده پس قبل از آن ۱۵ خانه مربوط به عنصرها یا همان الکترونها وجود دارد. در دوره اول هیدروژن و هلیم برابر
و در دوره دوم عناصر لیتیم و بریلیم (بلوک s) و عناصر بور تا نئون (بلوک p) به صورت هستند. در دوره یا لایه سوم دو عنصر سدیم و منیزیم در بلوک به صورت و عناصر آلومینیوم تا گوگرد که برابر ۴ الکترون در بلوک p به صورت است. پس آرایش الکترون این عنصر به صورت کلی برابر
خواهد بود.
به همین روش آرایش الکترونی عنصر تیتانیوم را بنویسید.
عنصر تیتیانیوم با عدد اتمی ۲۲ در دوره ۴ قرار دارد که متعلق به عناصر واسطه داخلی است. برای نوشتن آرایش الکترونی دوره یک تا ۳ همانند مثالهای قبلی عمل میکنیم. بنابراین آرایش الکترونی عناصر تا این دوره برابر
است. حال در دوره ۴ دو عنصر متعلق به بلوک s و دو عنصر متعلق به بلوک d است. در اینجا توجه داشته باشید که مهم است در ابتدا الکترونهای مربوط به اوربیتال d و بعد از آن مربوط به اوربیتال s را در آرایش الکترونی لحاظ کنید. پس در این دوره هم آرایش الکترونی عنصر تیتانیوم به صورت
خواهد بود. پس آرایش الکترونی کامل این عنصر به صورت زیر نوشته میشود:
به کمک این روش بسیار ساده نیز میتوان آرایش الکترونی فشرده را نوشت. برای این کار گاز نجیب ما قبل آن را در کروشه بنویسید و در نهایت همانند مثالهایی که توضیح داده شده عمل کنید. آرایش الکترونی تیتانیوم را در که بالا نوشیتیم میخواهیم به صورت فشرده به کمک همین روش بنویسیم. قبل این عنصر،گار نجیب آرگون وجود دارد، پس نام این گاز را در کروشه قرار دهید
. در نهایت عناصر مربوط به دوره چهارم برای بلوک s و بلوک d میماند که در این دوره دو الکترون مربوط به ۳d و دو الکترون مربوط به ۴s است. درنتیجه آرایش الکترونی فشرده تیتانیوم به صورت زیر نوشته میشود:
نمونه سوال برای آرایش الکترونی عناصر
در ادامه برای تسلط بیشتر شما بر آرایش الکترونی نمونه سوالاتی طرح شده که پاسخ آنها به صورت تشریحی توضیح داده شده است.
۱- آرایش الکترونی عناصر زیر را بنویسید:
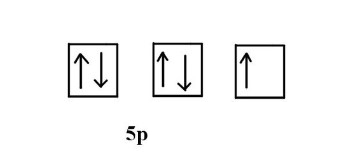
۲- الف) آرایش الکترونی عنصر ید را به صورت فشرده بنویسید.
ب) چه تعداد الکترون غیر پیوندی در این عنصر وجود دارد؟
برای پاسخ به این سوال باید از آرایش الکترونی مربوط به آن کمک بگیریم و به الکترونهای ظرفیت آن نگاه کنیم. پنجمین لایه عنصر، مربوط به لایه ظرفیت است که هفت الکترون دارد. دو الکترون از این هفت الکترون مربوط به اوربیتال s و و پنج الکترون مربوط به اوربیتال p است. از آنجا که در اوربیتال s دو الکترون حداکثر مقدار ممکن الکترونی است که میتواند قرار بگیرد بنابراین الکترونهای موجود در این اوربیتال کامل است. اما در اوربیتال p حداکثر تعداد مجاز الکترون برابر ۶ است. طبق آرایش الکترونی فوق، طبق اصل طرد پائولی و قانون هاند میتوان اوربیتالهای این عنصر را مانند تصویر زیر ترسیم کرد. از تصویر زیر مشخص است که یک الکترون غیر پیوندی وجود دارد.
۳- الف) توضیح دهید که چگونه آرایش الکترونی نوشته میشود و چرا در شیمی اهمیت بسیار بالایی دارد؟
حل: آرایش الکترونی با توجه به نکات زیر نوشته میشود:
- تعداد الکترون هر عنصر که توسط عدد اتمی عنصر مشخص میشود.
- ترتیب پر شدن لایهها از الکترون که توسط اصل آفبا امکانپذیر است.
- حداکثر مقدار مجاز تعداد الکترونی که میتوانند در هر اوربیتال قرار بگیرند که این کمیت برای اوربیتالهای d، p، s و f به ترتیب برابر ۲، ۶، ۱۰ و ۱۴ الکترون است.
آرایش الکترونی از این جهت اهمیت دارد که تعداد الکترونهای ظرفیت هر عنصر را مشخص میکند و بدین ترتیب شیمی منحصر به فرد هر عنصر تعیین میشود.
ب) مفاهیمی مانند (هاند، اصل طرد پائولی و غیره) را تعریف کنید و توضیح دهید که هریک در نوشتن آرایش الکترونی چه نقشی دارند؟
حل: ابزارهایی که از آنها برای نوشتن آرایش الکترونی عناصر مورد استفاده قرار میگیرند عبارتند از پر شدن اوربیتالها، اصل طرد پائولی، قانون هاند و اصل آفبا. اوربیتالها به ترتیب خاصی از الکترون پر میشوند بنابراین ما باید مطابق ترتیب خاصی برای آرایش الکترونی پیش برویم، این ترتیب خاص توسط پیروی از اصل آفبا امکانپذیر است. اصل طرد پائولی بیان میکند که هیچ دو الکترونی وجود ندارند که چهار عدد کوانتومی در آنها یکی باشند.
قانون هاند بیان میکند الکترونها در ابتدا اوربیتالهای با سطوح انرژی یکسان را پر میکنند که این موضوع برای تشخیص جفت الکترونهای پیوندی و غیر پیوندی بسیار مناسب است.
۴- آرایش الکترونی سه عنصر در زیر آورده شده، تعیین کنید که آرایش الکترونی مربوط به کدام عنصر است؟
الف)
توان هر لایه تعداد الکترونهای آن لایه را در اوربیتالهای مربوطه نشان میدهد بنابراین برای بهدست آوردن عدد اتمی عنصر همه آنها را با هم جمع میکنیم (۲۶=۶+۲+۶+۲+۶+۲+۲). پس عدد اتمی این عنصر برابر ۲۶ است که این عدد اتمی به عنصر آهن اشاره دارد.
ب)
از جمع زدن الکترونها عدد اتمی برابر ۴۵ خواهد بود که نشاندهنده عنصر روبیدیم است.
ج)
عدد اتمی برابر ۸۴ بوده بنابراین این عنصر، عنصر پولونیوم است.
د)
این عنصر ۱۶ الکترون دارد پس مربوط به گوگرد است.
۵- مقادیر
و
را برای عنصر منیزیم بدست آورید.
برای پاسخ به این سوال بهتر است که در ابتدا آرایش الکترونی را نوشت. عنصر منیزیم ۱۲ الکترون دارد پس آرایش الکترونی آن به صورت زیر است:
همانطور که مشاهده میشود بزرگترین لایه یعنی لایه ظرفیت برابر ۳ بوده یعنی n برابر ۳ است. l هم مقادیری بین یعنی ۰، ۱ و ۲ را شامل میشود.
برابر تا است در نتیجه مقدار این کمیت برابر با ۲-، ۱-، ۰، ۱ و ۲ خواهد بود. اسپین الکترونها نیز میتواند هر دو مقدار و
را اختیار کند.
۶- آرایش الکترونی عنصری با اطلاعات زیر را بنویسید.
با توجه به توضیحات بالا شماره لایه ظرفیت عنصر مربوطه چهار و
برابر ۳ است یعنی این عنصر اوربیتال f دارد. از آنجا که یعنی اگر از سمت چپ اوربیتال f هر خانه را که متعلق به یک
است بشمارید شماره ۴ مربوط به عدد صفر خواهد بود. به دلیل اسپین ذکر شده در صورت سوال تمام الکترونها رو به جهت بالا قرار گرفتهاند. پس اوربیتال f دارای ۴ الکترون رو به بالاست که آرایش در لایه ظرفیت با توجه به اطلاعات فوق در تصویر زیر نشان داده شده است.

حال با داشتن آرایش الکترونی لایه ظرفیت و اصل آفبا میتوان به آرایش الکترونی زیر رسید.
این آرایش الکترونی مربوط به عنصر نئودیوم (Nd) است.
جمع بندی
در این مطلب با بررسی اوربیتالها، تعداد لایهها، حداکثر تعداد الکترونی که میتواند در هر زیرلایه وجود داشته باشد و جهت قرار گرفتن الکترون در هر اوربیتال یاد گرفتیم که آرایش الکترونی عناصر را چگونه رسم کنیم. ۴ اوربیتال به نامهای d، p، s و f وجود دارد که در هر زیرلایه حداکثر تعداد الکترونی که میتواند وجود داشته باشد به ترتیب برابر ۲، ۶، ۱۰ و ۱۴ است. در هر اوربیتال الکترونها به گونهای قرار میگیرند که جهت آنها در خلاف هم باشند. هر الکترون در اوربیتال با یک آدرسی تعیین میشود که به این آدرس اعداد کوانتومی میگویند.
این اعداد شامل ۴ عدد کوانتومی هستند که هر یک از آنها نشاندهنده مفهومی در رابطه با الکترون است. این ۴ عدد کوانتومی عبارتند از:
: به این عدد عدد کوانتومی اصلی میگویند که تعداد لایهها را نشان میدهد. تعداد لایهها از ۱ تا ۷ با توجه به عدد اتمی عنصر متغیر است. به عنوان مثال در عنصر سدیم دو لایه و در عنصر اوگانسون ۷ لایه وجود دارد.
: شکل و تعداد اوربیتال را نشان میدهد. به عنوان مثال شکل اوربیتال p به صورت دمبلی است به همین جهت
آن یک است. مقدار این عدد کوانتومی برای سه اوربیتال دیگر (d، s و f) به ترتیب برابر ۰، ۲ و ۳ است.
: این عدد کوانتومی جهتگیری اوربیتال در فضا را نشان میدهد که براساس مولفههای برداری $x و $z$$$ است و مقادیری برابر و
را شامل میشود.
: جهتگیری اسپینها را در فضا نشان میدهد و معمولا هریک از الکترونها در اوربیتالها در جهتهای بالا و پایین
قرار میگیرند. توجه داشته باشید که در آرایش الکترونی ابتدا الکترونهای رو به جهت بالا در اوربیتال پر میشوند و بعد از آن که در همه اوربیتالها این الکترونها قرار گرفتند در صورت وجود الکترون با توجه به عدد اتمی، الکترونهایی که جهت آنها رو به پایین است قرار میگیرند.
برای نوشتن یا ترسیم آرایش الکترونی عناصر میتوانید به ترتیب مراحل زیر را طی کنید:
- به عدد اتمی عنصر مورد نظر نگاه کنید زیرا عدد اتمی به شما تعداد الکترونهای موجود در اطراف هسته اتم نشان میدهد.
- به کمک اصل آفبا به ترتیب اوربیتالها را از الکترونها پر کنید.
- در آرایش الکترونی عناصر واسطه یعنی عناصری که به اوربیتال d ختم میشوند در ابتدا الکترون در اوربیتال s و بعد از آن الکترون در اوربیتال p قرار میگیرد.
- همچنین توجه داشته باشید که برخی از اوربیتالها با آرایش الکترونی نیمهپر و پر پایدارترند به همین دلیل برخی از عناصر (برخی از عناصر واسطه) از اصل افبا پیروی نمیکنند پس باید به این نکته دقت کنید.
سوالات مرتبط با آرایش الکترونی عناصر
در این قسمت به سوالاتی که در رابطه با آرایش الکترونی عناصر به صورت مکرر پرسیده میشود به صورت خلاصه پاسخ داده شده است.
۳ اصل ضروری برای رسم آرایش الکترونی عناصر جدول کدامند؟
برای ترسیم آرایش الکترونی عناصر سه اصل وجود دارد که باید طبق آنها آرایش الکترونی مربوط به عنصرها را نوشت. این اصول عبارتند از: اصل آفبا، اصل طرد پائولی و قانون هاند.
آرایش الکترونی چه اهمیتی دارد؟
ازجمله اهمیت آرایش الکترونی عناصر میتوان به مشخص شدن تعداد الکترون در لایه ظرفیت اشاره کرد. همچنین آرایش الکترونی مشخص میکند که عنصر در کدام یک از بلوکهای d، p، s و f تقسیمبندی میشود. بسیاری از خواص فیزیکی و شیمیایی عنصرها ازجمله نقطه ذوب، نقطه جوش، انرژی پیوند به آرایش الکترونی برمیگردد. به همین دلیل آرایش الکترونی در شیمی از اهمیت بسیار بالایی برخوردار است.
ترتیب سطوح انرژی در آرایش الکترونی چیست؟
ترتیب قرارگیری الکترونها در اتم، آرایش الکترونی نام دارد و این الکترونها برحسب ترتیب سطوح انرژی
و
لایهها را پر میکنند.
بالاترین سطح انرژی برای آرایش الکترونی عنصر چه نام دارد؟
به بزرگترین سطح انرژی که الکترونها در آن پر می شوند و از هسته هم فاصله بیشتری نسبت به سایر لایهها دارد لایه ظرفیت و به الکترونهایی که در آن قرار میگیرند الکترونهای ظرفیت میگویند.
به چه الکترونهایی الکترونهای غیرپیوندی میگویند؟
برای رسم آرایش الکترونی در دیاگرام اوربیتالی، هر اوربیتال به صورت یک مربع در نظر گرفته میشود که در هر مربع دو الکترون میتوانند در جهتهای محتلف قرار بگیرند. همانطور که اشاره کردیم در ابتدا در هر خانه مربعی ابتدا الکترونها رو به بالا پر میشوند و بعد از آن در صورت وجود الکترون، الکترونها رو به پایین قرار میگیرند. در صورتی که در یک اوربیتال تنها یک الکترون وجود داشته باشد به آن الکترون، الکترون غیر پیوندی میگویند و در آن اوربیتالهایی که دو الکترون وجود داشته باشد الکترونهای پیوندی میگویند.
آرایش الکترونی فشرده چیست ؟
آرایش الکترونی گازهای نجیب یا گازهای بیاثر پایدار است زیرا تعداد الکترونهای ظرفیت در لایه ظرفیت برابر ۸ است. ترسیم آرایش الکترونی گازها بر اساس گازهای نجیب، آرایش الکترونی فشرده نام دارد. به این صورت که عنصری که ۳۹ الکترون داشته باشد قبل از آن ۴ گاز نجیب هلیوم، نئون، آرگون و کریپتون وجود دارد که از میان آنها عنصر کریپتون نزدیکترین گاز نجیب به این عنصر است زیرا ۳۶ الکترون دارد. بنابراین به جای ۳۶ الکترون نماد عنصر کریپتون را در داخل کروشه قرار میدهیم و ۳ الکترون مابقی از نقطهای که باید آرایش الکترونی ادامه داشته باشد را ادامه میدهیم.
بزرگترین عنصر در جدول تناوبی کدام است؟
در جدول تناوبی بزرگترین عنصر، عنصر فرانسیم است. زیرا این عنصر در گروه ۱ و دوره ۷ جدول تناوبی قرار دارد و چون طبق قانون دورهای عنصرها در گروه از بالا به پایین شعاع اتمیف افزایش و در دوره از چپ به راست کاهش پیدا میکند. پس عنصر فرانسیم در پایین گروه و در قسمت چپ جدول قرار دارد بنابراین بزرگترین شعاع اتمی را دارد درنتیجه بزرگترین عنصر است.