قانون دوره ای عنصرها تکرار خواص فیزیکی و شیمیایی عناصر را به هنگام طبقهبندی آنها بر اساس افزایش عدد اتمی نشان میدهد. بسیاری از خواص بر اساس قانون دوره ای در فاصلههای معینی از جدول تناوبی تکرار میشوند. زمانی که عنصرها به شیوهای صحیح طبقهبندی شوند تکرار خواص مربوط به آنها میتواند به پیشبینی ویژگی و خواص عناصر کشف نشده کمک بزرگی کند. در این مطلب با بررسی جدول تناوبی یاد خواهیم گرفت قانون دوره ای عنصرها چیست و با طبقهبندی آنها بر اساس این قانون آشنا خواهیم شد.
قانون دوره ای عنصرها چیست ؟
قانون دورهای عنصرها نشان میدهد که با ترتیب قرار گرفتن عناصر براساس افزایش عدد اتمی خواص فیزیکی و شیمیایی عنصرها تکرار و به شکل قابل پیشبینی شدهای تنظیم میشوند. در واقع به کمک قانون دورهای و تکرار روند خواص عنصرها میتوان رفتار و ویژگیهای عناصر را پیشبینی کرد.
مقدمه ای بر قانون دوره ای
در سال ۱۸۰۴ فیزیکدانی به نام «جان دالتون» (John Dalton) نظریه اتمی مواد را ارائه داد و در راستای تعیین جرم اتمی کمک بزرگی به جامعه دانشمندان کرد. در همان زمان دو دانشمند دیگر به نامهای «سر همفری دیوی» (Sir Humphry Davy) و «مایکل فارادی» (Michael Faraday) سبب توسعه و رشد شاخهای از شیمی به نام «الکتروشیمی» شدند که این موضوع به کشف بسیاری از عناصر کمک کرد. از طرفی در سال ۱۸۲۹ شیمیدانی به نام «یوهان ولفگانگ دوبراینر» (Johann Wolfgang Dobereiner) مشاهده کرد که بعضی از عناصر مانند کلر، برم و ید؛ کلسیم، استرانسیم و باریم؛ گوگرد، سلنیم و تلوریم؛ آهن، کبالت و منگنر که با یکدیگر خواص مشابهی دارند گروههایی را تشکیل میدهند که در هر گروه هر خانواده از عناصر ذکر شده قرار میگیرند.

در زمانی که این موضوع ارائه شد عناصری محدودی کشف شده بود و در مورد جرم مولکولی و جرم اتمی عناصر سردرگمیهای بسیاری وجود داشت. به همین دلیل شیمیدانها در آن زمان، از درک نظریه این دانشمند عاجر بودند. در سال ۱۸۵۹ دو فیزیکدان با نامهای «ویلیام بونسن» (willhem Bunsen) و «گوستاو رابرت کیرشهف» (Gustav Robert Kirchhoff) طیف سنجی را اختراع کردند که توسط آن امکان کشف بسیاری از عناصر وجود داشت و برای دانشمندان به ابزاری برای مقایسه عناصر با هم تبدیل شد.
تاریخچه جدول تناوبی عناصر و چگونگی تکمیل آن
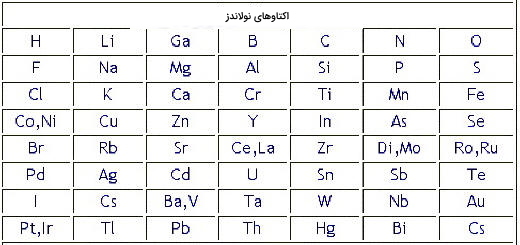
به این ترتیب در سال ۱۸۶۴ «جان نولاندز» (J.A.R Newlands) عناصر را بر اساس افزایش جرم اتمی میانگین طبقهبندی کرد و با این کار متوجه شد که خواص شیمیایی هر ۷ عنصر مشابه هم هستند. او دستاورد خود را قانون اکتاو نامگذاری کرد. از جمله اشتباهات قانون جان نولاندز میتوان به پیش بینی نکردن جاهای خالی برای عناصری که هنوز کشف نشده بود و قرار دادن برخی از عناصر در محلهای اشتباه اشاره کرد. به عنوان مثال همانطور که در تصویر نشان داده شده است او آهن را در گروه اکسیژن و گوگرد که همگی میدانیم این دو عنصر نافلز هستند، قرار داد.
در سالهای ۱۸۶۴ تا ۱۸۷۰ «لوتار مایر» (Lothar Meyer) اولین نفری بود که تکرار شدن خواص عناصر را در گروههای جداگانه نشان داد و قانون خود را بر اساس حجم اتمی ( تقسیم جرم اتم بر چگالی اتم) پایهگذاری و آن را حجم مولی نامگذاری کرد. رابطه حجم مولی در تصویر زیر آورده شده است. بدین ترتیب در سال ۱۸۶۹ این دانشمند قانون دوره ای عنصرها را نیز معرفی کرد.
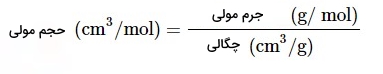
در سال ۱۸۶۹ «دیمیتری مندلیف» (Dmitri Mendeleev) دانشمند روسی قانون دوره ای عنصرها را بنیانگذاری کرد. طبق این قانون زمانی که طبقهبندی عنصرهای شیمیایی بر اساس افزایش جرم اتمی صورت میگیرد عناصر به گروههایی تقسیمبندی میشوند که هر کدام از این گروهها خواص مشابهی دارند. همانطور که در پاراگراف قبلی توضیح داده شد مندلیف اولین کسی نبود که گروهبندی عناصر را بر اساس تکرار خواص نشان داد. اما اکثر ما افراد به هنگام شنیدن یا دیدن جدول تناوبی، نام مندلیف در ذهنمان نقش میبندد. میتوان گفت که تلاشهای مندلیف در این زمینه بیشتر از سایر دانشمندان مورد توجه قرار گرفت و به همین دلیل است که جدول تناوبی به نام جندول مندلیف نیز شناخته میشود. جدول تناوبی که مندلیف بر اساس قانون دوره ای، عنصرها را طبقهبندی کرد در تصویر زیر آورده شده است.
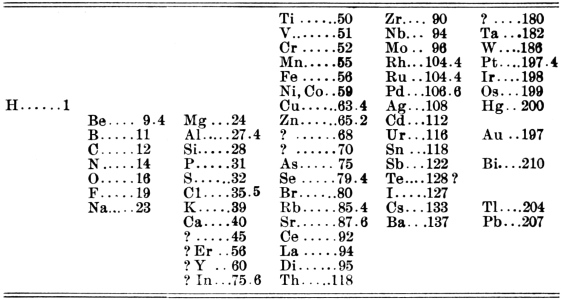
دلیل این امر آن است که این دانشمند روسی سهم قابل توجهی در شکلگیری جدول تناوبی مدرن دارد. به گونهای که عناصر جدیدی که کشف میشدند با وجود گذشت چندین سال از ارائه جدول مندلیف و قانون دوره ای اما آن عناصر طبق همان قانون قرار میگرفتند. به گونهای که ویژگیهای این عناصر نیز با ویژگیهای پیشبینی شده توسط مندلیف همخوانی داشتد یا نزدیک بودند. به طور کلی جدول تناوبی که برپایه قانون دوره ای توسط مندلیف شکل گرفت به دو دلیل اهمیت ویژهای دارد.
همچنین در ریسموک بخوانید:
نامه وزیر بهداشت به معاون رئیسجمهور درباره حقوق و مالیات اساتید
۱. تعیین کردن جای خالی برای عناصری که تا آن زمان هنوز کشف نشده بودند. به گونهای که کشف عناصر جدید با قرار گرفتن در جای خود، نظم سایر گروههای جدول تناوبی را به هم نمیزدند.
۲. پیشبینی خواص عناصر کشف نشده و نامگذاری آنها یکی از دلایل دیگر اهمیت دستاورد مندلیف است. به عنوان مثال مندلیف برای عنصری به نام «اکا آلومینیوم» به معنای عنصری با خواصی مشابه با خواص آلومینیوم که وجود آن را پیشبینی کرده بود جایی را در جدول تناوبی به آن اختصاص داد. او همچنین خواص و ویژگیهای این عنصر مربوطه را پیشبینی کرد. به عنوان مثال مندلیف پیشبینی کرد که نقطه ذوب اکا آلومینیوم پایین است و نسبت به عنصر آلومینیوم ماده فرارتری است. بعد از کشف این عنصر نام آن را گالیم (Ga) نامیدند که خواص آن شباهت بسیاری با خواص پیشبینی شده توسط مندلیف داشت.

جدول تناوبی مندلیف
با طبقهبندی جدول تناوبی توسط مندلیف انقلاب بسیار بزرگی در علم شیمی و تمامی رشتههای وابسته به این علم رخ داد. در جدول تناوبی، عناصر بر اساس افزایش جرم اتمی در گروههایی تقسیم بندی میشوند که خواص آنها در این طبقهبندی تکرار میشود. با این حال جدول تناوبی مندلیف دارای نقصهایی بود که این ارجمله آنها میتوان به موارد زیر اشاره کرد:
- مندلیف نتوانست جایی را در جدول تناوبی به عنصر هیدروژن اختصاص دهد.
- با حرکت از برخی عناصر به سمت عناصر دیگر در جدول، روند افزایش جرم اتمی نقض میشد به همین دلیل تعداد عناصری که تا آن زمان هنوز کشف نشده بودند به طور دقیق مشخص نبود.
- با پدیدارشدن موضوعی به نام ایزوتوپ، ایزوتوپهای عناصر با قانون دوره ای عنصرها در تناقض بودند.
عدد اتمی اساس قانون دوره ای عنصرها
با توجه به اینکه طبقهبندی عناصر بر اساس افزایش جرم اتمی یک سری مشکلات به همراه داشت مندلیف در طبقهبندی برخی عناصر در جدول تناوبی، مشابه بودن خواص شیمیایی را بر روند افزایش جرم اتمی ترجیح داد. به عنوان مثال در هنگام ترتیب دادن عناصر به عنصر پتاسیم با جرم اتمی ۳۹/۱ رسید و متوجه شد که این عنصر خواصی مشابه با عنصر سدیم دارد بنابراین جایگاه صحیح آن را بعد از عنصر سدیم و در همان گروهی که سدیم حضور داشت، قرار داد. اما از طرفی عنصر آرگون با جرم اتمی ۳۹/۹ قبل از عنصر پتاسیم قرار گرفته بود زیرا این عنصر از خواصی مشابه با عنصر نئون برخوردار بود و باید در همان گروه قرار میگرفت.
در این صورت قرارگیری دو عنصر آرگون و پتاسیم در تناقض با با روند افزایش جرم اتمی بود زیرا همانطور که در بالا توضیح داده شد جرم اتمی آرگون بیشتر از پتاسیم است اما با این حال قبل از آن قرار گرفته است. به همین دلیل مندلیف برای طبقهبندی این دو عنصر و برخی از عناصر دیگر مانند همین مثال ترجیح داد که قانون روند افزایش جرم اتمی را نقض کند تا عناصری با خواص مشابه در کنار هم و در یک گروه قرار بگیرند. سرانجام در سال ۱۹۱۳ دانشمندی به نام «هنری موزلی» (Henry Gwyn Jeffreys Moseley) بر روی اندازهگیری طیف اشعه ایکس عنصرهای شیمیایی آزمایش می کرد که اعلام کرد انرژی اوربیتالهای الکترونی، فرکانس نشر شده توسط اشعه ایکس را نشان میدهد و این انرژی به بار هسته، بار هسته اتمهای هدف (آند) بستگی دارد.

بنابراین موزلی توانست رابطهای بین فرکانس اشعه ایکس و تعداد بارهای هسته پیدا کند که این رابطه در زیر آورده شده است.
در رابطه فوق
، و و
به ترتیب فرکانس اشعه ایکس، عدد اتمی و اعداد ثابت هستند. به این ترتیب هنرلی موزلی توانست مفهوهی به نام عدد اتمی را به جامعه علمی شیمی معرفی کند. او پیشنهاد داد که جدول تناوبی مندلیف بر اساس افزایش عدد اتمی بازبینی و اصلاح شود. بنابراین قانون دوره ای عنصرها در جدول تناوبی امروزه بر پایه افزایش عدد اتمی است. در این صورت زمانی که عناصر براساس افزایش عدد اتمی طبقهبندی میشوند خواص شیمیایی تکرار میشود.
بنابراین عدد اتمی آن فاکتوری است که خواص شیمیایی عناصر را تعیین میکند. همانطور که در قسمتهای فوق توضیح داده شد جرم اتمی آرگون بیشتر از پتاسیم بود با این حال قبل از عنصر پتاسیم قرار گرفته بود که این موضوع با روند افزایش جرم اتمی در تناقض بود اما کاملا با روند افزایش عدد اتمی تطابق دارد زیرا عدد اتمی آرگون کمتر از عدد اتمی پتاسیم است.
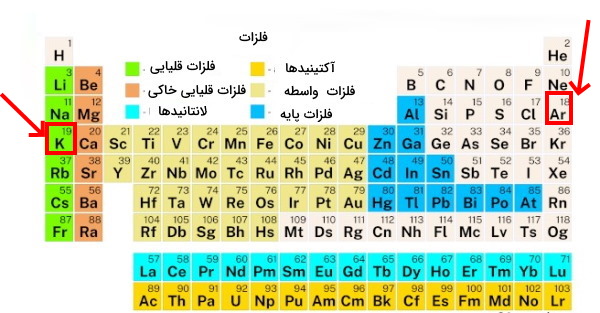
قانون دوره ای عنصرها کمک کرد تا بسیاری از ویژگیهای عناصر ازجمله نقطه ذوب و جوش، چگالی، رسانایی الکتریکی، واکنشپذیری، اسیدی، بازی، ظرفیت، قطبی و انحلالپذیری را مشخص شوند.جدول زیر نشان میدهد که عنصرها بر اساس افزایش عدد اتمی از چپ به راست طبقهبندی شدهاند. ستونهای عمودی خواصی مشابه با سایر عناصر هم گروه خود دارند. به عنوان مثال ویژگیهای عنصر لیتیوم شبیه به ویژگیهای عنصر سدیم است. بریلیوم شبیه به عنصر منگنز است و عناصر دیگر هم به همینگونه رفتاری مشابه از خود نشان میدهند.
| گروه | ۱ | ۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ |
| عنصر | لیتیم | بریلیم | بور | کربن | نیتروژن | اکسیژن | فلوئور | نئون |
| عدد اتمی | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ |
| عدد جرمی | ۶/۹۴ | ۹/۰۱ | ۱۰/۸۱ | ۱۲/۰۱ | ۱۴/۰۱ | ۱۵/۹۹ | ۱۸/۹۹ | ۲۰/۱۸ |
| عنصر | سدیم | منیزیم | آلومینیوم | سیلیسم | فسفر | گوگرد | کلر | آرگون |
| عدد اتمی | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ |
| جرم اتمی | ۲۲/۹۹ | ۲۴/۳۱ | ۲۶/۹۸ | ۲۰/۰۹ | ۳۰/۹۷ | ۳۲/۰۷ | ۳۵/۴۵ | ۳۹/۹۵ |
اهمیت قانون دوره ای عنصرها چیست ؟
قانون دوره ای عنصرها به عنوان یکی از مهمترین مفاهیم در شیمی به شمار میرود. هر شیمیدانی که با عناصر، ویژگیها و واکنشهای شیمیایی بین آنها سر و کار داشته باشد به صورت مستقیم یا غیرمستقیم از جدول تناوبی استفاده میکند. بنابراین جدول تناوبی در علم شیمی نقش بسیار مهمی را ایفا میکند. پس اگر شما هم فردی هستید که در آزمایشگاه شیمی دبیرستان یا دانشگاه و یا در کار خود با ترکیبات و فرایندهای شیمیایی سر و کار دارید بهتر است که یاد بگیرید قانون دوره ای عنصرها چیست زیرا یادگیری این جدول کمک بسیاری بزرگی میکند. قانون دوره ای سبب پیدایش جدول تناوبی مدرن شد که قدم بسیار بزرگی در پیشرفت علم به شمار میرود.
جدول تناوبی مدرن
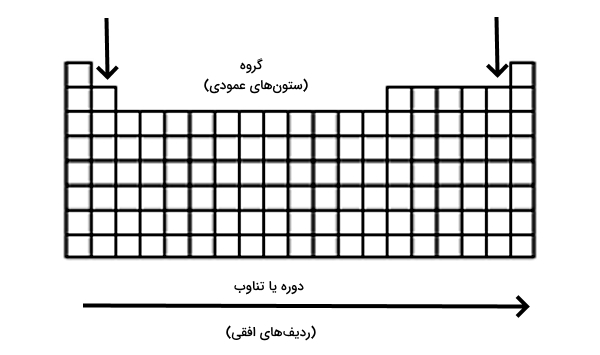
شکل کنونی جدول تناوبی که امروزه در سراسر جهان مورد استفاده قرار میگیرد «جدول تناوبی مدرن» نام دارد. در این شکل از جدول تناوبی ردیفهای افقی و ستونهای عمودی به ترتیب «دوره» یا تناوب (Period) و «گروه» (Group) نام دارند. گروهها شامل عناصری هستند که آرایش الکترونی لایههای بیرونی در اتمهای آنها مانند هم است. در قدیم گروهها به صورت IA،…VIIIA، VIII، IB…VIIB و صفر – گروه مربوط به گازهای نجیب نامگذاری شده بودند. اما اکنون شماره گذاری این گروههابه صورت اعداد ۱ تا۸ است.
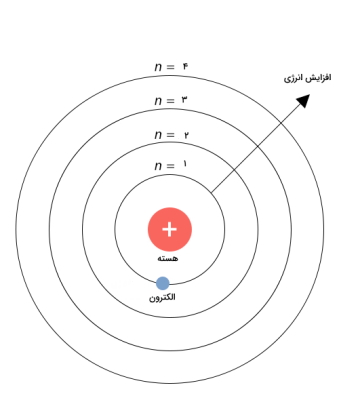
در جدول تناوبی مدرن، دورهها شامل هفت ردیف هستند و عدد کوانتومی اصلی (n) که تعداد لایههای الکترونی را نشان میدهد مشخص کننده ردیفها در گروه است. در حقیقت ردیف در جدول تناوبی تعداد لایههای الکترونی را مشخص می کند.
برای مثال همانطور که در تصویر زیر نشان داده است n برابر با ۴ است یعنی عنصر معین دارای ۴ لایه الکترونی است.
دوره و گروه در جدول تناوبی
جدول تناوبی دارای ۷ دوره و ۱۸ گروه است که هر دوره و گروه دارای تعداد عناصری با خواصی مشابه است. در ادامه برای اینکه متوجه شویم قانون دوره ای عنصرها چیست به بررسی دورهها و گروههای جدول تناوبی میپردازیم.
طبقهبندی عنصرها در دوره
جدول تناوبی عناصر شامل همه خواص شیمیایی مربوط به عنصرهایی که کشف یا ساخته شدند است. آنها براساس افزیش عدد اتمی در هفت ردیف با لانتانیدها ( لانتانیوم با عدد اتمی ۵۷ تا لوتسیم یا لوتتیوم با عدد اتمی ۷۱) و آکتینیدها (اکتینیوم با عدد اتمی ۸۹ تا لورنسیم با عد اتمی ۱۰۳) که به صورت جداگانه در زیر جدول آورده شدهاند طبقهبندی شدهاند. طول دورهها متفاوت است به عبارتی که در دورهها تعداد عناصری که قرار گرفته یکسان نیست.
به عنوان مثال دوره یک شامل دو اتم هیدروژن و هلیوم است. دو دوره کوتاه در جدول تناوبی وجود دارد که در هر دوره ۸ عنصر است و دوره اولی مربوط به عناصر لیتیوم تا نئون و دومی مربوط به عناصر سدیم تا آرگون است. همچنین دو دوره بلند در جدول تناوبی است که در هر کدام ۱۸ عنصر وجود دارد دوره اولی مربوط به عناصر پتاسیم تا کریپتون و دوره بعدی مربوط به عنصرهای روبیدیم تا زنون است. جدول تناوبی بر اساس قانون دوره ای عنصرها دارای دو دوره خیلی بلند است. اولین دوره خیلی بلند با ۳۲ عنصر در جدول تناوبی مربوط به دورهای است که از عنصر سزیم شروع و به عنصر رادون (۱۸ عنصر) ختم میشود. با احتساب ۱۴ عنصر در لانتانیدها که در زیر جدول تناوبی نشان داده شده است اعضای این دوره ۳۲ عنصر خواهد بود.
دوره بعدی مربوطه به دوره ۷ جدول تناوبی است که ازعنصر فرانسیم شروع و به عنصر اوگانسون ختم میشود که در این مورد هم با حساب کردن اکتینیدها در زیر جدول تعداد عنصرهای این دوره به ۳۲ عنصر خواهد رسید. دوره ۷ آخرین دوره از جدول تناوبی است.
طبقهبندی عنصرها در گروه
در جدول تناوبی ۱۸ گروه وجود دارد که در این قسمت هر گروه به طور جداگانه توضیح داده میشود:
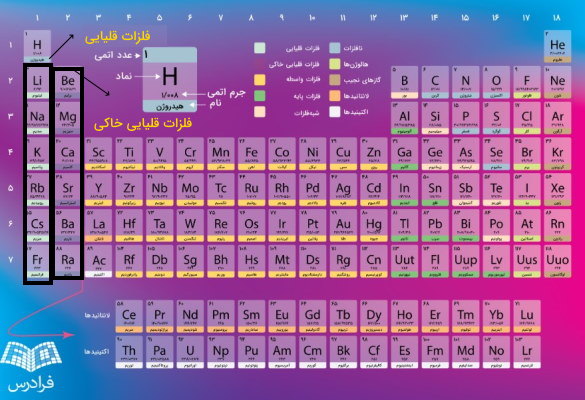
گروه ۱ و ۲ جدول تناوبی
گروه ۱ (IA) به جز هیدروژن مربوط به فلزات قلیایی است که از عنصر لیتیم شروع و به فرانسیم ختم میشود. آرایش الکترونی این عناصر در لایه ظرفیت یا همان لایه آخر به
ختم میشود. در این گروه ۷ عنصر وجود دارد که یکی از این عناصر هیدروژن است. بله درست حدس زدید هیدروژن نافلز است اما در گروه فلزات قلیایی خاکی وجود دارد زیرا آرایش الکترونی هیدروژن است به همین خاطر در گروه ۱ قرار میگیرد. زیرا همانطور که در قسمتهای قبلی توضیح دادیم گروهها شامل عناصری هستند که آرایش الکترونی لایههای بیرونی در اتمهای آنها مانند هم هستند. گروه دوم (IB) مربوط به فلزات قلیایی خاکی هستند که آرایش الکترونی آنها به ختم میشود و شامل فلزات کلسیم، بریلیم، منیزم، استارنسیم، باریم و رادیم است. توجه کنید به عناصر گروههای ۱ و ۲ فلزات دسته یا بلوک
میگویند.
گروه ۳ تا ۱۲ جدول تناوبی
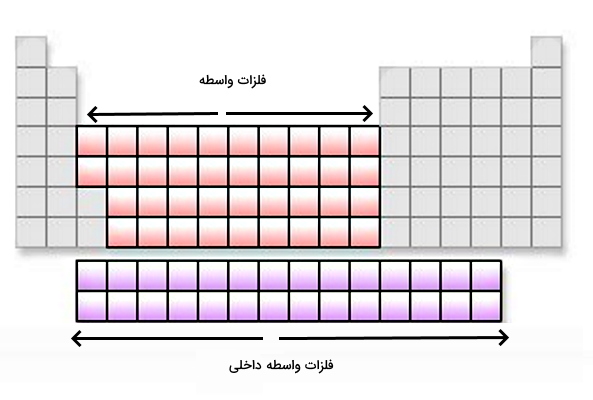
گروههای ۳ تا ۱۲ (IIIB تا IIB) بخش بزرگی از جدول تناوبی را به خود اختصاص میدهند و دارای تعداد عناصر زیادی هستند. آرایش الکترونی این فلزات به
ختم میشود. به همین دلیل به این عناصر، فلزات بلوک d یا فلزات واسطه خارجی میگویند زیرا زیر لایههای d آنها در حال پر شدن است. در سیستم آیوپاک (IUPAC) به این عناصر «فلزات انتقالی» نیز میگویند و نامگذاری این نام به دلیل موقعیت و انتقال خواص آنها از زیرلایههای s و p است. به همین خاطر همه فلزات انتقالی، فلزات دسته d هستند اما همه فلزات دسته d فلزات انتقالی نیستند. لازم به ذکر است که عناصر لانتانیدها و آکتینیدها به عنوان عناصر واسطه داخلی شناخته میشوند که اوربیتالهای ۴F و ۵F آنها در حال پر شدن است.
گروه ۱۳ تا ۱۸ جدول تناوبی
گروه ۱۳ تا ۱۸ (IIIA تا VIIIA) جدول تناوبی، عناصر مختلفی را از جمله فلزات پسواسطه (Post-transition metal)، نافلزات و شبه فلزات در بر میگیرد. فلزات پس واسطه مانند آلومینیوم و گالیم در گروههای ۱۳ تا ۱۶ پراکنده شدهاند. شبه فلزات شامل ۶ عنصر بور، سیلیسیم، ژرمانیوم، آرسنیک، آنتیموان، تلریوم است. نافلزات شامل هالوژنها در گروه ۱۷ (VIIA)، گازهای نجیب در گروه ۱۸ و عناصر کربن، نیتروژن، اکسیژن، فسفر، بور است. همچنین همانطور که در قسمتهای قبلی توضیح داده شد هیدروژن نیز با وجود اینکه در گروه ۱ وجود دارد اما جزء نافلزات به شمار میرود. به این نکته دقت کنید که همه عناصر گروه ۳ تا ۱۸ جز عنصر هلیم در عناصر بلوک p قرار میگیرند.
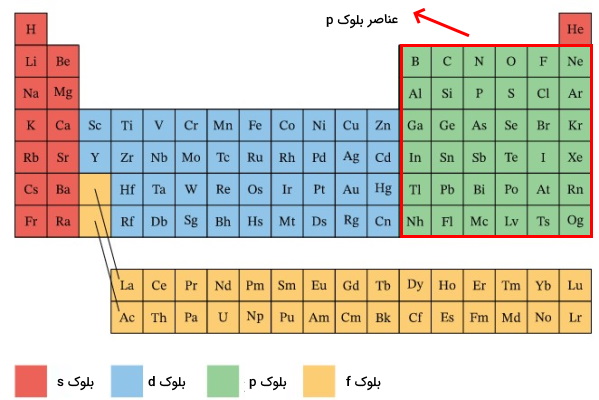
به دلیل اینکه آرایش الکترونی عنصر هلیم به
ختم میشود در دسته عناصر s قرار میگیرد. اما از آنجا که آرایش الکترونی آن به صورت کاملا پر و گاز هم است در گروه ۱۸ یعنی گازهای نجیب قرار میگیرد. درضمن آرایش الکترونی گازهای نجیب به
ختم میشود.
خواص حاصل از قانون دوره ای عنصرها
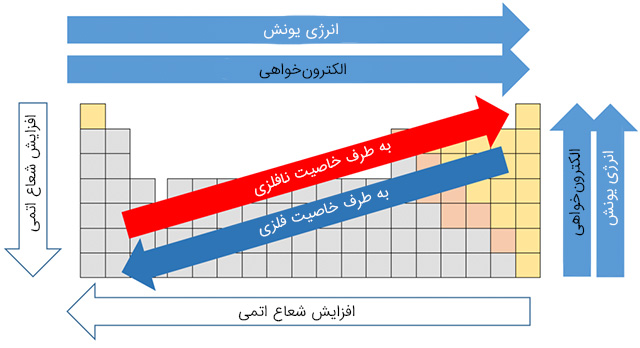
یک سری خواص مهم و کلیدی با توجه به قانون دوره ای عنصرها در جدول تناوبی تکرار میشود و از اهمیت بسیار بالایی برخوردار است . ازجمله این خواص میتوان به شعاع اتمی، انرژی یونش، الکترونگاتیوی و الکترون خواهی یا «میل ترکیبی الکترون» (Electron affinity) اشاره کرد.
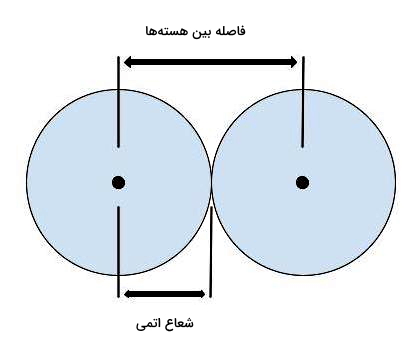
شعاع اتمی
شعاع اتمی یا یونی معیاری برای اندازهگیری تک اتم یا یون است و برابر با نصف فاصله هستههای دو اتم (مانند شعاع دایره) است. در گروه جدول تناوبی، شعاع اتمی از بالا به پایین افزایش و در دوره از چپ به راست کاهش پیدا میکند. دلیل این امر آن است که در گروه از بالا به پایین عدد کوانتومی اصلی یعنی تعداد لایه ها افزایش پیدا میکند. به عنوان مثال آرایش الکترونی عنصر سدیم با عدد اتمی ۱۱ به
ختم میشود که نشان میدهد تعداد لایه آن برابر ۳ است. از طرفی آرایش الکترونی عنصر پتاسیم با عدد اتمی ۱۹ که در پایین عنصر سدیم قرار دارد به
ختم میشود بنابراین تعداد لایههای این عنصر ۴ است. بنابراین تعداد لایهها در پتاسیم نسبت به سدیم افزایش پیدا کرده است که این موضوع نشاندهنده افزایش شعاع اتمی است.
و اما در دوره با ثابت بودن تعداد لایهها، تعداد پروتونها در هسته و تعداد الکترون در لایهها افزایش پیدا میکند که باعث میشود بار مثبت اتم بیشتر شود. توجه داشته باشید که اثر یک پروتون در مقایسه با الکترون بسیار بیشتر است به همین دلیل جاذبه هسته بالا میرود و سبب کشاندن الکترون ها به سمت خود میشود. در نتیجه الکترونهای ظرفیت به هسته نزدیکتر میشوند و به این صورت شعاع اتمی کاهش پیدا میکند.
انرژی یونش
معیاری برای جدایش یک الکترون از اتم یا یون است. هر چقدر که الکترون راحتتر از اتم یا یون جدا یا در اصطلاح یونیده شود انرژی یونش کمتر خواهد بود. بنابراین با توجه به توضیحات بالا طبیعتا انرژی یونش در گروه از بالا به پایین کاهش و در دوره از چپ به راست افزایش پیدا میکند.
الکترونخواهی
این خاصیت در واقع تمایل به دریافت الکترون را نشان میدهد که یک اتم چقدر میتواند الکترون بپذیرد. با استفاده از قانون دورهای عنصرها و ویژگیهای ذکر شده در بالا می توان نتیجه گرفت که عنصرهای قلیایی و قلیایی خاکی الکترونخواهی کمی دارند. در مقابل هالوژنها به راحتی الکترون میگیرند تا زیرلایه های خود را پر کنند بنابراین الکترونخواهی بالایی دارند یا به عبارتی تمایل زیادی را برای دریافت الکترون نشان میدهند.
الکترونگاتیوی
الکترونگاتیوی با الکترونخواهی ارتباط مستقیمی دارد. الکترونگاتیوی تمایل اتم را برای جذب جفت الکترون اشتراکی به هنگام برقرای پیوند شیمیایی نشان میدهد. الکترونگاتیوی همانند الکترونخواهی در گروه از بالا به پایین کاهش و در دوره از چپ به راست افزایش پیدا میکند. الکتروپوزیتوی ویژگی دیگری است که نیز در دوره تناوبی تکرار میشود و برعکس الکترونگاتیوی است. عناصری مانند سزیوم و فرانسیوم که الکتروپوزیتیو هستند الکترونگاتیوی پایینی دارند.
در تصویر زیر روند تغییرات شعاع اتمی، الکترونخواهی، الکترونگاتیوی و انرژی یونش در گروه و دوره آورده شده است.
علاوه بر این موارد ویژگیهای دیگری در رابطه با قانون دوره ای عنصرها وجود دارد که ممکن است به عنوان ویژگیهای عناصر در نظر گرفته شود. به عنوان مثال همه عناصر گروه ۱ (قلیایی) براق هستند، عدد اکسایش آنها برابر
است، با آب واکنش میدهند و اغلب در طبیعت به شکل آزاد وجود ندارند و به صورت ترکیب یافت می شوند.
سوالات مرتبط با قانون دوره ای عنصرها
در این بخش سوالات مرتبط و پرتکرار در رابطه با قانون دوره ای گردآوری و پاسخ داده شده است. این سوال و پاسخها به شما کمک خواهد کرد که یاد بگیرید قانون دوره ای عنصرها چیست و با روند خواص آنها آشنا شوید.
قانون تناوبی چیست؟
قانون تناوبی یا همان دوره ای عنصرها نشان میدهد زمانی که عناصر شیمیایی بر اساس افزایش عدد اتمی در کنار هم طبقهبندی میشوند روند خواص در آنها تکرار میشود. به کمک این تکرار میتوان خواص و ویژگیهای عناصر کشف نشده را نیز پیشبینی کرد یعنی همان کاری که مندلیف در زمان تنظیم جدول تناوبی انجام داد.
اساس قانون دوره ای عنصرها چیست؟
با کشف عدد اتمی توسط هنری موزلی مبنای طبقهبندی عنصرها در جدول تناوبی افزایش عدد اتمی قرار گرفت. بنابراین جدول تناوبی تنظیم شده توسط مندلیف که بر اساس افزایش جرم اتمی صورت گرفته بود بر اساس افزایش عدد اتمی اصلاح شد. بدین ترتیب امروزه اساس قانون دوره ای عنصرها،افزایش جرم اتمی است.
عنصرها در جدول تناوبی چگونه طبقهبندی شدهاند؟
بر اساس قانون دوره ای عنصرها در جدول تناوبی ۱۸ گروه یا ستون و ۷ ردیف یا تناوب وجود دارد. هر گروه یا ردیف از عنصرهایی با خواصی مشابه به هم تشکیل شدهاند.
در قانون دوره ای عنصرها چه خواصی تکرار میشوند؟
قانون دوره ای عنصرها در جدول تناوبی سبب تکرار یک سری خواص مهم و کلیدی میشود که این خاصیتهای شیمایی از اهمیت بالایی برخوردار هستند . ازجمله این خواص می توان به شعاع یونی، انرژی یونش، الکترونگاتیوی و الکترونخواهی یا «میل ترکیبی الکترون» (Electron affinity) اشاره کرد. شعاع اتمی یا شعاع یونی در گروه از بالا به پایین افزایش و در دوره از چپ به راست کاهش پیدا می کند. انرژی یونش، الکترونگاتیوی و الکترون خواهی در گروه از بالا به پایین کاهش و در دوره از چپ به راست افزایش پیدا میکنند.