بدن انسان برای دفاع از خود در برابر میکرواورگانیسمهای مزاحم از سدهای دفاعی مختلف استفاده میکند. دفاع غیر اختصاصی مجموعه از مکانیسمهای دفاعی عمومی است که همیشه در بدن وجود دارد و در پاسخ به پاتوژنها شدت آن افزایش مییابد. برای مثال پوست اولین خط دفاعی ثابت در بدن است که بهوسیله لایههای سلولی استراتوم و لیزوزوم عرق از ورود باکتریها به بخشهای داخلی محافظت میکند. اما تعداد و فعالیت سلولهای ایمنی ذاتی، در پاسخ به عفونت افزایش مییابد. در این مطلب انواع دفاع اختصاصی و مکانیسمهای آن را توضیح میدهیم.
+ همچنین در ریسمونک بخوانید:
دفاع غیر اختصاصی بدن چیست ؟
بدن انسان از میلیونها سلول مختلف تشکیل شده است که با محیط بیرون در ارتباط است. محیط اطراف علاوه بر عناصر طبیعی از میکرواورگانیسمهای مختلفی تشکیل شده است که بعضی از آنها برای بدن انسان خطرناک است و با ایجاد تغییر در عملکرد بخشهای مختلف بیماری ایجاد میکند. به همین دلیل بدن بهوسیله سیستم ایمنی از خود در برابر این میکرواورگانیسمها محافظت میکند. «دفاع غیراختصاصی» (Innate Immune System) بخشی از سیستم ایمنی بدن است که اجزای آن از ورود پاتوژنها به بدن یا انتقال آن به بخشهای داخلی جلوگیری میکنند. پاسخهای این سیستم به مولکولهای سطحی پاتوژنها بستگی ندارد و برای همه انواع پاتوژن (باکتریها، قارچها، ویروسها یا ذرات موجود در هوا) ثابت است. چهار مکانیسم اصلی در این نوع دفاع از بدن شرکت میکنند.
- سدهای فیزیکی بدن: اولین خط دفاعی انسان در برابر پاتوژنها، سد فیزیکی دفاع غیر اختصاصی است. پوست، مژک و مخاط سلولهای پوششی (بینی، لوله گوارش، مسیرهای تنفسی و اندامها تولیدمثلی) و مژهها، سد فیزیکی دفاع غیر اختصاصی هستند.
- سد شیمیایی: سکرتینها، مخاط یا موکوز، صفرا، اسید معده، بزاق، اشک، عرق، ایمونوگلوبین A و تغییرات pH از مولکولهای دفاع غیر اختصاصی بدن هستند.
- سد زیستی: باکتریهای مفید یا «فلور نرمال» (Normal Flora) بدن در مناطق مرتبط با محیط بیرونی بدن (حفره بینی-حلقی، دهان و گلو، پوست، لوله گوارش و واژن) قرار دارند. رقابت این باکتریها با باکتریهای پاتوژن یکی از سدهای دفاع غیر اختصاصی است.
- پاسخ ایمنی عمومی: التهاب، پروتئینهای مکمل یا سیستم کامپلمان و پاسخ غیر اختصاصی سلولهای ایمنی مکانیسمهای دفاعی غیر اختصاصی برای محافظت بدن در برابر پاتوژنها هستند.
دفاع غیر اختصاصی پوست
پوست اولین خط دفاعی برای جلوگیری از ورود میکرواورگانیسمها به بدن است. این اندام از لایههای مختلف سلولی، غدد اگزوکرین عرق و سلولهای ایمنی تشکیل میشود. این اندام از سه لایه اپیدرم (خارجی)، درم (میانی) و درونپوست (داخلی) تشکیل شده است. اپیدرم خارجیترین بخش پوست است که در بخشهای مختلف بدن ضخامت متفاوتی (۰٫۵ میلیمتر در پلک چشم و ۱٫۵ میلیمتر در کف دست و پاشنه پا) دارد.
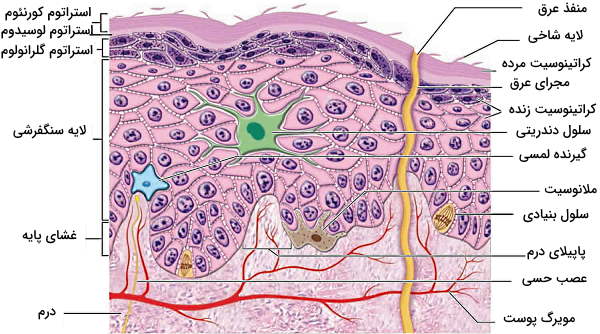
اپیدرم از پنج لایه مختلف (از خارج به داخل: استراتوم کورنئوم، استراتوم لوسیدوم، استراتوم گرانولوزوم، لایه سلولهای سنگفرشی و غشای پایه) تشکیل میشود که خارجیترین لایه آن یا استراتوم کورنئوم (لایه شاخی) از ۱۰ تا ۳۰ لایه سلولهای کراتینوسیت مرده تشکیل میشود. این لایه سلولی مرده از بافتهای داخلی در برابر نورخورشید، تبخیر آب، ورود میکروبها و آسیبهای فیزیکی محافظت میکند. سلولهای لایه شاخی هر ۲۸ تا ۳۰ روز در افراد جوان و هر ۴۵ تا ۵۰ روز در افراد پیر با سلولهای جدید لایه زیری (استراتوم گرانولی) جایگزین میشوند. سلولهای دندریتی (سلولهای لانگرهانس) از سلولهای ایمنی موجود در لایه سنگفرشی پوست هستند که پاتوژنها را فاگوسیت میکنند.
سد شیمیایی دفاع غیر اختصاصی
سد شیمایی دفاع غیر اختصاصی از عوامل محیطی و مولکولهای شیمیایی تشکیل می شود. تغییر pH و دما عوامل محیطی هستند که از ورود یا آسیب رساندن پاتوژنها به بدن جلوگیری میکنند. pH اسیدی پوست (۵٫۵)، لوله گوارش (۱٫۳) و واژن (۴٫۴) با دناتوراسیون پروتئینها از رشد بسیاری از میکرواوگانیسمها جلوگیری میکند. ایمونوگلوبولین A، لیزوزیم، موکوز، دیفنسین و پروتئازها مولکولهای آنتیباکتریالی هستند که سد شیمیایی را تشکیل میدهند.
- ایمونوگلوبولین A: ایمونوگلوبولین A یکی از آنتیبادیهای غیراختصاصی بدن است که در اشک، بزاق و ترشحات غشای مخاطی وجود دارد. پلاسماسلهای مستقر در لایه لاملا پروپریا (زیرمخاط) وظیفه سنتز این پروتئینها را بر عهده دارند.
- لیزوزیم: لیزوزیم (مورامیداز، N-استیل مورامیک هیدرولاز یا پپتیدوگلایکان N-استیل موراموئیل هیدرولاز) آنزیمی است که با هیدرولیز لایه پپتیدوگلایکان (پیوند بتا ۱ به ۴) در دیواره سلولی باکتری از بدن محافظت میکند. در این آنزیم در بسیاری از ترشحات بدن (بزاق، اشک، شیر مادر و مخاط) و وزیکولهای سیتوپلاسمی سلولهای ایمنی (ماکروفاژ و نوتروفیل) وجود دارد.
- موکوز: موکوز یا مخاط ترکیبی از پروتئین موسین و آب است که بهوسیله سلولهای گابلت یا جامی شکل در بافت پوششی حفرهها و مجاری بدن ترشح میشود. این ترکیب لزج و چسبنده، پاتوژنها را به دام میاندازد. پاتوژنهای به دام افتاده در لوله گوارش بهوسیله حرکات دودی و در مسیرهای تنفسی بهوسیله حرکت مژک سلولهای پوششی دفع و از بدن خارج میشوند.
- دیفنسین: دیفنسینها پروتئینهای کوچکی هستند که بهوسیله گلبولهای سفید خون و سلولهای بافت پوششی سنتز میشوند. آلفا و بتا دیفنسین دو دسته اصلی این پروتئینها در مهرهداران را تشکیل میدهند. بتا دیفنسین در سلولهای پوششی سنتز میشود و با بهمریختن ساختار غشای پلاسمایی و ایجاد حفره در آن باکتری را از بین میبرد. آلفا دیفنسین در ماکروفاژها، نوتروفیلها و سلولهای پنز روده سنتز و در سیتوپلاسم سلول ذخیره میشود.
- پروتئازها: پروتئازهای لوله گوارش (پپسین، تریپسین و اندوپپتیدازهای پانکراس) با پروتئولیز از رشد باکتریها جلوگیری میکنند.
سد زیستی دفاع غیر اختصاصی
باکتریهای فلور نرمال علاوه بر سنتز برخی ویتامینها (K و
) و گوارش فیبرهای سلولزی، با پاتوژنهای برای جایگاه اتصال به بافت و منابع غذایی رقابت میکنند. به همین دلیل مصرف بدون تجویز و بیش از نیاز آنتیبیوتیکها با کاهش باکتریهای مفید احتمال ابتلا به عفونتها باکتریایی را افزایش میدهد.
پاسخ ایمنی عمومی
پاسخ ایمنی عمومی از مکانیسمهای ایمنی سریع برای حفاظت بدن بره میبرد. این واکنشها برای یک نوع آنتیژن خاص برای مثال توکسین باکتری کلستریدیوم تتانی (عامل کزاز) فعال نمیشود. بلکه لایه لیپوگلایکان دیواره سلولی همه باکتریهای گرم منفی را به عنوان پاتوژن میشناسد و به همه آنها پاسخ یکسانی میدهد. این بخش از سیستم ایمنی با مشارکت لوکوسیتها، سیتوکینهای پیامرسان و گیرندههای شناسایی الگو (Pattern-Recognition Receptors | PRRs) انجام میشود و از واکنشهای التهابی، پروتئینهای مکمل، اینترفرونها و افزایش دمای بدن (تب) برای مبارزه با عامل مهاجم استفاده میکند.
سلول های سیستم ایمنی غیر اختصاصی
لوکوسیتها یا گلبولهای سفید گروهی از سلولهای خونی هستند که در دفاع غیر اختصاصی بدن شرکت میکنند. این سلولها با فاگوسیتوز پاتوژن یا ترشح ترکیبات شیمیایی از بدن دفاع میکنند.
- ماکروفاژها: ماکروفاژها، مونوسیتهایی هستند که با عبور از مویرگ، پاتوژنهای بافتی را فاگوسیتوز میکنند. در شرایط فیزیولوژیک بدن و عدم حضور پاتوژن، تعداد ثابتی از ماکروفاژها در برخی بافتهای بدن ازجمله آلوئولهای ریه مستقر است. این سلولها با ترشح سیتوکین، لوکوسیتهای دیگر را به محل عفونت جذب میکنند.
- ماست سلها: ماستسلها، سلولهای ایمنی مستقر در بافت پیوندی (سنتز آنزیم تریپتاز، کیماز و کربوکسیپپتیداز) و غشای مخاطی (سنتز آنزیم تریپتاز) اندامهای مختلف بدن هستند که با تحریک سیستم التهابی در ترمیم زخم و دفاع غیر اختصاصی بدن شرکت میکنند. این سلولها برای تحریک واکنشهای التهابی، هیستامین و برای فراخوانی سایر لوکوسیتها سیتوکین ترشح میکنند.
- نوتروفیلها: نوتروفیلها گروه دیگری از فاگوسیتها هستند که در سیتوپلاسم آنها گرانولهای (حاوی سیتوکین) فراوانی وجود دارد. تعداد زیاد این گرانولوسیتها در خون سبب میشود اولین گلبولهای باشند که به محل عفونت میرسند.
- ائوزینوفیلها: ائوزینوفیلها یکی از انواع گرانولوسیتهایی (گلبول سفید با وزیکولهای سیتوپلاسمی فراوان) هستند که با ترشح سیتوکین و رادیکالهای آزاد نقش مهمی در دفاع غیر اختصاصی بدن علیه باکتریها و انگلها ایفا میکنند. این سلولهای درصد کمی (۱ تا ۶ درصد) از گلبولهای سفید خون را به خود اختصاص میهند اما در بافت تیموس، لوله گوارش و تخمدان، رحم، طحال و گرههای لنفاوی تعداد زیادی فراوانی زیادی دارند.
- بازوفیلها: بازوفیلها، گرانولوسیتهایی هستند که با ترشح هیستامین (در کنار ماستسلها) در پاسخ به آلرژنها شرکت میکنند.
- سلولهای کشنده طبیعی: این سلولهای سیستم دفاع غیر اختصاصی مستقیم به پاتوژنها حمله نمیکنند، بلکه سلولهای آلوده به پاتوژن را از بین میبرند.
- سلولهای دندریتی: سلولهای دندریتی در بافت پوست و غشای مخاطی (بینی، ریه، معده و روده) وجود دارند. سلولهای دندریتی از اولین سلولهای ایمنی هستند که پاتوژن را شناسایی و بین ایمنی غیر اختصاصی و اکتسابی ارتباط برقرار میکنند.
تشکیل گلبول های سفید
تمام سلولهای خون ازجمله گلبولهای سفید در مغز استخوان و از تمایز «سلولهای بنیادی خونساز» (Haematopoietic stem cells | HSCs) در این بخش از استخوان تشکیل میشوند. از تقسیم میتوزی این سلول دو دسته سلول میلوئیدی و لنفوئیدی به وجود میآید. از تمایز این سلولها دو رده لنفوسیتها و لوکوسیتهای میلوئیدی ایجاد میشوند.
- از تمایز سلولهای رده لنفوئیدی، لنوبلاست و از تمایز لنفوبلاستها لفوسیتهای T، لنفوسیتهای B و «سلولهای کشنده طبیعی» (Natural Killer Cells) ایجاد میشوند.
- از تمایز سلولهای میلوئدی، میلوسیتها و از تمایز میلوسیتها «سلولهای اجدادی اریتروپویتیک» (Erythropoietic Progenitors) و «مگاکاریوتیک» (Magakaryotic Progenitors) ایجاد میشوند. گرانولوسیتها و مونوسیتها از تمایز این رده سلولی ایجاد میشوند.
لنفوسیت های دفاع اختصاصی کدامند ؟
لنفوسیتها گلبولهای سفید تک هستهای هستند که بیشتر آنها در دفاع اختصاصی بدن شرکت میکنند. NKC ها تنها لنفوسیتهای سیستم دفاع غیر اختصاصی هستند که سلولهای آلوده به ویروس یا سرطانی را با سه مکانیسم مختلف از بین میبرند. به علاوه این سلولها با ترشح سینوکینهای
و
ماکروفاژها و سلولهای دندریتی را فعال میکنند. ژن گیرنده MHC I در تمام سلولهای هستهدار بدن انسان بیان میشود و آنتیزنهای خودی بدن انسان را تعیین میکند. در سلولهای آلوده به ویروس و سرطانی بیان ژن و تعداد این گیرندهها در سلول کاهش مییابد. NKC با شناسایی کاهش گیرندهها و فعال کردن مسیر آپوپتوز سلول را از بین میبرد. ماکروفاژ و نوتروفیل باقیماندههای سلولی را فاگوسیتوز میکنند. دو مکانیسم فعالسازی آپوپتوز در این سلولها وجود دارد.
- NKC لیگاندی پروتئینی به نام «لیگاند فاس» (Fas Ligand) ترشح میکند. این لیگاند به گیرندههای سطح سلول آلوده به ویروس یا سرطانی متصل و مسیر آپوپتوز را فعال میکند.
- NKC با ترشح پرفورین و گرانزیم مسیر آپوپتوز را فعال میکند. مولکولهای پرفورین پروتئینهای ساختاری هستند که در غشای سلول آلوده کانالهایی برای ورود گرانزیم ایجاد میکنند. گرانزیم با هیدرولز پروتئینهای سلولی مرگ برنامهریزیشده را تحریک میکند.
گیرنده های سیستم دفاع غیر اختصاصی
انتقال پیام و عملکرد سلولهای دفاع غیراختصاصی وابسته به گیرندههای سطح سلولی به نام گیرندههای شناسایی کننده الگو است. انواع مختلف این گیرنده در سطح لوکوسیتها و لنفوسیتهای سیستم دفاع غیر اختصاصی توالی خاصی از مولکولها در آنتیژنهای میکروبی (PAMPs) یا سلولهای آسیبدیده خودی (DAMPs) را شناسایی میکنند. گلایکانها (لیپوگلایکان دیواره سلولی باکتری گرم منفی، مورامیل پپتید دیواره باکتری گرم مثبت و بتا-۱ و ۳-گلایکان دیواره سلولی قارچها)، پروتئینها (فلاژلین در تاژک باکتریها) و اسید نوکلئیک (DNA یا RNA ویروسی)، لیگاندهای غیرخودی این گیرندهها هستند.
برهمکنش این گیرندهها بیان سیتوکینها در سلولهای ایمنی را تحریک میکنند. تعداد این گیرندهها در سطح سلولهای ارائهکننده آنتیژن بیشتر است. «رسپتورهای تول لایک» (Toll-like receptors | TLRs)، «رسپتور اتصالی به دومین اولیگومریزاسیون نوکلئوتید» (Nod-like receptors | NLRs)، رسپتور لکتین نوع C از انواع این گیرندهها هستند.
رسپتور Toll Like
رسپتورهای تول-لایک، پروتئینهای عرض غشایی هستند که به بخشهای پاتوژنی (پروتئینهای سطحی، اندوتوکسین، لیپید A یا DNA ویروسی) میکروبها پاسخ میدهند. این گیرندهها برخلاف رسپتورهای همراه G پروتئین تنها یک بخش عرض غشایی دارند و علاوه بر غشای پلاسمایی در غشای وزیکولهای سیتوپلاسمی قرار دارند. تعداد TLRs در غشای سلولهای دندریتی و ماکروفاژها بیشتر است. ۱۳ کلاس این گیرنده در پستانداران شناخته شده است که ژن کدکننده ۱۱، ۱۲ و ۱۳ در انسان وجود ندارد. کلاسهای مختلف این گیرنده در پاسخ به پاتوژنهای متفاوتی فعال میشوند.
- دیمر TLR۱ و TLR۲: دیمر این گیرندهها در پاسخ به پاتوژنهایی پاسخ میدهند که پروتئینهای «لنگر گلیکوفسفاتیدیل اینوزیتول» (GPI-anchoring Proteins) یا لیپوپروتئین دارند. مولکول پاتوژنیک انگلها معمولا از این نوع است.
- دیمر TLR۲ و TLR۶: این دو گیرنده در پاسخ به زایموسان (مولکول پاتوژن قارچ) و لیپوتایکوئیک اسید (دیواره سلولی باکتریهای گرم مثبت) تشکیل دیمر میدهند.
- هومودیمر TLR۴: دو TLR4 کنار هم در پاسخ به لیپوپلیساکارید (دیواره سلولی باکتریهای گرم منفی) دیمر تشکیل میدهند.
- هومودیمر TLR۵: دو گیرنده TLR5 کنار هم در پاسخ به فلاژلین (پروتئین تاژک در باکتریها) فعال میشوند و دیمر تشکیل میدهند.
- هومودیمر TLR۱۱: این گیرنده در سطح سلولهای ماکروفاژهای سیستم ادراری-تولید مثلی قرار دارد و در پاسخ به باکتریهای آلوده کننده لولههای ادراری-تناسلی هومودیمر تشکمیل میدهد.
- هومودیمر TLR۳: این گیرنده در غشای وزیکولهای سیتوپلاسمی قرار دارد و در پاسخ به DNA دورشتهای ویروس فعال میشود.
- هومودیمر TLR۷: این هومودیمر در پاسخ به RNA تکرشتهای ویروس در سطح وزیکولهای سیتوپلاسمی تشکیل میشود.
- هومودیمر TLR۸: این هومودیمر در پاسخ به RNA دورشتهای ویروس تشکیل میشود.
- هومودیمر TLR۹: این گیرنده در غشای وزیکولهای داخل سلول قرار دارد و در پاسخ به توالی غنی از بازهای سیتیدین و گوانین (CpG DNA) فعال میشود.
فعال شدن این گیرندهها (غشای پلاسمایی و وزیکولی) واکنشهای آبشاری درون سیتوپلاسم و سه فاکتور رونویسی AP1 (پروتئینهای مسیر پیامرسانی)، IRF (سنتز اینترفرون) و NFkB (سنتز سیتوکینهای
،
و IL18) را فعال میکند. این سیتوکینها با افزایش پاسخ التهابی به سیستم دفاع غیر اختصاصی برای حذف پاتوژنها کمک میکنند.
رسپتور اتصالی به دومین اولیگومریزاسیون نوکلئوتید
این رسپتورها پروتئینهای سیتوپلاسمی هستند که کلاسهای مختلف آن PAMPs متفاوتی را شناسایی میکنند. AIM۲ در سیتوپلاسم سلولهای خونساز DNA باکتریایی و ویروسی را شناسایی میکند. اتصال این لیگاندها به رسپتور سنتز فاکتورهای التهابی و مسیر آپتوزی کاسپاز-۱ را فعال میکند. NOD۱ و NOD۲ انواع درون غشایی این گیرندهها هستند که پپتیدوگلایکان باکتریایی را شناسایی میکنند.
رسپتور لکتین نوع C
این پروتئینهای عرض غشایی گلایکانهای دیواره سلولی باکتریایی و قارچی را شناسایی میکند. بخش سیتوپلاسمی این گیرندهها با فعال کردن مسیر کیناز اسکای، رونویسی ژنهای سلول ایمنی را فعال میکند.
رسپتورهای شبیه RIG-۱
رسپتورهای شبیه ژن رتینوئیک اسید-۱ (Retinoic Acid-Inducible Gene ۱) گیرندههای سیتوپلاسمی DNA ویروسی را شناسایی میکنند. اتصال DNA-رسپتور در سلولهای ایمنی، سنتز پروتئینهای ضد ویروسی ازجمله اینترفرون ۱ را تحریک میکند.
پیام رسانی در دفاع غیر اختصاصی
سیتوکینها پروتئینهای کوچکی (از ۵ تا ۲۵ کیلودالتون) هستند که در پیامرسانی سیستم ایمنی شرکت میکنند. کموکین، اینترفرون، اینترلوکین، لیمفوکین و فاکتورهای نکروزکننده تومور انواع سیتوکینهای پیامرسان را تشکیل میدهند. ژن کدکننده این پروتئینها در ماکروفاژها، لنفوسیتهای B، لنفوسیتهای T ماستسلها، سلولهای اندوتلیال و فیبروبلاستها وجود دارد. یکی از تفاوتهای مهم سیتوکینها با هورمون در این است که سیتوکینها بهوسیله بسیاری از سلولها در بدن ترشح میشوند. اما یک نوع هورمون بهسویله یک نوع سلول خاص ترشح میشود. برای مثال انسولین فقط بهوسیله سلولهای پانکراس ترشح میشود اما سلولهای اپیتلیال و ماکروفاژها اینترلوکین ۱ را ترشح میکنند.
سنتز این مولکولها با سنتز موقتی و تنها در پاسخ به آنتیژن، نیمهعمر کوتاه در مایعات بدن (خون و مایه میانبافتی) و بیان محدود گیرنده آن در سلولهای فعال و غیرفعال، تنظیم میشود. سیتوکینهای مختلف که یک زمان مشخص برای ایجاد پاسخ ایمنی در بدن ترشح شدهاند با هم برهمکنشهای متفاوتی دارند.
- «اثر پلیوتروپیک» (Pleiotropic): مسیرهای متفاوتی در سلولهای هدف مختلفی را فعال میکنند.
- «اثر کاهشی» (Redundant): این سیتوکینها اثر مشابهی بر سلول هدف دارند.
- «سیتوکینهای همافزا» (Synergic): این سیتوکینها با همکاری هم در سلول هدف تغییر ایجاد میکنند. اثر این مولکولها به هم وابسته است.
- «اثر آنتاگونیست» (Antagonistic): یکی از سیتوکینها، اثر مولکول دیگر را خنثی میکند.
- القای واکنشهای آبشاری: در این روش سیتوکینها واکنشهای زیستی متوالی برای افزایش سنتز یک نوع سیتوکین را القا میکنند.
کموکین
کموکینها پروتئینهای کوچک سیستم ایمنی هستند که در جذب سلولهای ایمنی به محل عفونت نقش مهمی دارند. اتصال متوالی گیرنده غشای پلاسمای سلولهای ایمنی به این مولکولها حرکت لوکوسیتها در جهت شیب غلظت کموکین را تسهیل میکند. به این فرایند کموتاکسی گفته میشود. گیرنده این مولکولها در غشای سلول ایمنی از نوع رسپتور همراه G پروتئین است. اتصال گیرنده-کموکین در این سلولها واکنشهای آبشاری درونسلولی را فعال میکند که در نهایت با افزایش اینتگرینهای غشا و پلیمریزاسیون اکتین، تشکیل پای کاذب، قطبی شدن سلول (تفاوت ترکیب غشا در بخش نزدیک به و دور از کموکین) و حرکت سلول را تحریک میکند.
این مولکولها بر اساس توالی آمینواسیدی نامگذاری میشوند. کموکینهای CC و CCX انواعی از این مولکول هستند که دو اسیدآمینه اول در توالی چهار آمینواسیدی محافظتشده آنها سیستئین است. به علاوه میتوان این مولکولها را بر اساس عملکرد تقسیمبندی کرد.
- کموکینهای التهابی در پاسخ به سیتوکینها ترشح میشوند
- کموکینهای هموستاتیک در شرایط فیزیولوژیک ترشح میشوند. این کموکینها در مهاجرت لنفوسیتها از تیموس به رگهای لنفاوی نقش دارند.
پاسخ التهابی دفاع غیر اختصاصی
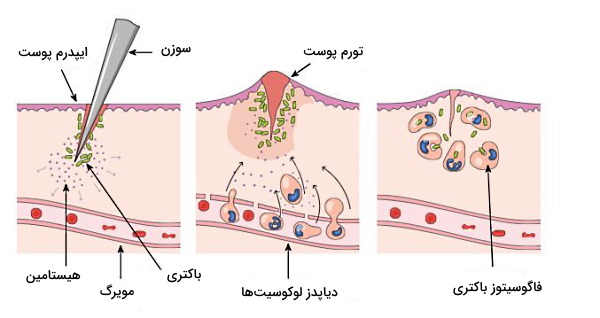
التهاب مکانیسمی برای حذف بقایای سلولی (سلول نکروز شده بدن یا پاتوژنها) از خون است. هر عامل پاتولوژیک (باکتری، نکروزه شدن بافت) و محیطی (آلودگی شیمیایی، سوختگی پوست) که به بافت آسیب برساند منجر به فعال شدن این مکانیسم میشود. برای توضیح این مکانیسم، پاسخ التهابی به عفونت باکتری گرم مثبت را بررسی میکنیم. این باکتریها پس از ورود به بدن اندوتوکسینی ترشح میکنند که با فرایندهای مختلف سبب تحریک پاسخ التهابی میشود.
- اندوتوکسین به بافتهای سالم آسیب میرساند. آنزیم فسفولیپاز A۲ فسفولیپید آزاد شده از غشا را به آراشیدونیکاسید تبدیل میکند. از واکنشهای آنزیمی این اسید چرب غیر اشباع و ۲۰ کربنه، با آنزیم لیپواکسیژناز (COX ۱,۲) لوکوترینها و با آنزیم سیکلواکسیژناز پروستوگلاندین سنتز میشود.
- اتصال این مولکولها به گیرنده ماستسلها ترشح تعداد بسیار زیادی از مولکولهای هیستامین، «لوکوترین» (Leukotrienes) و «پروستوگلاندینها» (Prostaglandins) را تحریک میکند.
اتصال سیتوکینها (لوکوترین، پروستوگلاندین و هیستامین) به گیرنده سطح سلولهای اندوتلیال با انقباض سلولهای اندوتلیال فاصله بین سلولها و نفوذپذیری دیواره مویرگ را افزایش میدهد. در نتیجه ورود پلاسما از مویرگ به مایع میانبافتی افزایش مییابد (ادم). افزایش مایع میانبافتی و برادیکینین با تحریک گیرندههای درد را به همراه دارد. به علاوه اتصال سیتوکینها به گیرنده سطح سلولی ماهیچههای صاف دیواره رگ سبب شروع مرحله استراحت ماهیچه و افزایش قطر رگ (وازودایلیشن | Vasodilation) میشود. افزایش قطر رگ با افزایش جریان خون به ناحیه التهابی، در نتیجه قرمز و گرم شدن بافت همراه است.
اتصال سیتوکین-گیرنده در غشای سلولهای اندوتلیال حرکت وزیکولهای ذخیرهای به سطح لومنی این سلولها و افزایش سلکتینهای غشایی را تحریک میکند. در غشای مونوسیتها و گرانولوسیتهای خون گلیکوپروتئینهایی وجود دارد که با سلکتینهای برهمکنش میدهند و از ادامه حرکت این سلولها همراه جریان خون جلوگیری میکنند. P-CAMs پروتئینهای عرض غشایی دیگری در اندوتلیال هستند که با گلیکوپروتئینهای غشای پلاسمایی گلبولهای سفید برهمکنش میکنند. این برهمکنش خروج گرانولوسیتها و مونوسیتهای سیستم دفاع غیر اختصاصی از مویرگ (دیاپدز | Diapedesis) را تسهیل میکند. پس از ورود این سلولها به مایع میانبافتی، برهمکنش سیتوکین-گیرنده، گلبولهای سفید را به محل دقیق آسیب هدایت میکند (Positive Chemotaxis).
ماکروفاژ فعال شده با ترشح اینترلوکین ۱ (IL-۱) و فاکتور نکروزکننده تومور آلفا (
) پیام حمله پاتوژنی را به لوکوسیتهای دیگر منتقل میکنند. اتصال این مولکولها به گیرنده سطح بازالی غشای اندوتلیال، سنتز سلکتین-E و انتقال آن به غشای لومنی را افزایش میدهد. در نتیجه نوتروفیلها و مونوسیتهای بیشتری از جریان خون جدا و به سطح سلولهای اندوتلیال متصل میشوند. به علاوه اتصال اینترلوکین ۸ (IL-۸) آزاد شده از ماکروفاژ فعال به گیرنده سلولهای اندوتلیال، سنتز و انتقال مولکولهای I-CAM و V-CAM به غشای لومنی اندوتلیال را افزایش میدهد. این مولکول با فعال کردن اینتگرینهای غشای نوتروفیل، اتصال این لوکوسیت به P-CAMS و در نتیجه دیاپدز را تسهیل میکنند.
گیرنده
و IL-1 علاوه بر غشای پلاسمایی سلولهای اندوتلیال، در سلولهای هیپوتالاموس، کبد و مغز استخوان وجود دارد.
- اتصال این مولکول به گیرندههای هیپوتالاموس مسیر سنتز پروستوگلاندین ۲ (PG۲) را فعال میکند. این مولکول سبب افزایش دمای بدن و تب میشود. افزایش دمای بدن با دناتوراسیون پروتئینها از رشد میکرواورگانیسمها جلوگیری میکند.
- اتصال لیگاند-گیرنده در هپاتوسیتها مسیرهای تولید و ترشح «پروتئین پاسخدهنده به فاز حاد» (Acute Phase Reactant Proteins | APRP) را فعال میکند. افزایش این پروتئینها در خون یکی از روشهای تشخیص التهاب است.
- اتصال لیگاند-گیرنده در سلولهای مغز استخوان میتوز و تمایز سلولها را تحریک میکند. در نتیجه تعداد زیادی گلبول سفید جدید وارد جریان خون میشود.
تفاوت التهاب حاد و مزمن
التهاب حاد در بازه زمانی کوتاه و بر اثر آسیب جزئی بافت یا پاتوژنهای خارجی ایجاد میشود و یکی از مکانیسمهایی است که از آسیب بیشتر بدن جلوگیری میکند. التهاب مزمن در شرایطی ایجاد میشود که بدن نمیتواند برای مدتی طولانی بافت آسیبدیده را ترمیم کند و غلظت بالای سیتوکینها در خون منجر ایجاد التهاب در بازه زمانی طولانی (چند ماه تا چند سال) میشوند. بیماریهای قلبی عروقی، انواع سرطانها، دیابت، روماتوئید ارتیریتیس (روماتیسم)، بیماریهای مزمن کلیه، آسم آلرژیک، آلزایمر، سندروم متابپلیکی و سندروم خودایمنی چندگانه با التهاب مزمن همراه هستند.
فاگوسیتوز
فاگوسیتوز یکی از مکانیسمهای اصلی گلبولهای سفید سیستم دفاع غیر اختصاصی برای حذف پاتوژنها است. تغییر آرایش اکتینهای اسکلت سلولی در ماکروفاژ و نوتروفیل سبب تشکیل پای کاذب در این سلولها میشود. پای کاذب سلول باکتریایی (ویروسی، قارچی یا انگل) را احاطه میکند و پاتوژن با تشکیل وزیکول (فاگوزوم) وارد سیتوپلاسم میشود. در سیتوپلاسم، فاگوزوم با لیزوزوم ادغام شده (فاگولیزوزوم) و آنزیمهای هیدولازی همه مولکولهای ساختاری و عملکردی پاتوژن به جز آنتیژنها را تجزیه میکند. در این مرحله مسیر نوتروفیل و ماکروفاژ جدا میشود.
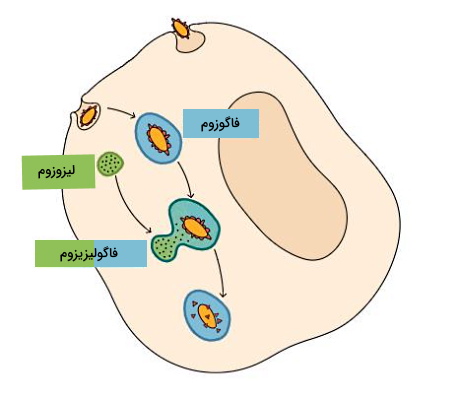
- نوتروفیلها سلولهای ارائهدهنده آنتیژن نیستند. فاگولیزوزوم این سلولها پس از تجزیه باکتری با غشای پلاسمایی ادغام و آنتیژن بهوسیله اگزوسیتوز وارد مایع میانبافتی و در نهایت لنف میشود.
- ماکروفاژها «سلولهای ارائهدهنده آنتیژن» (Antigen Presenting Cells) هستند. ژن «مجموعه سازگاری بافتی اصلی» (Major Histocompatibility Complex | MHC) در کروموزوم ۶ این سلولها قرار دارند و با نوترکیبی انواع مختلف این پروتئین غشایی برای آنتیژنهای مختلف را کد میکند. در این سلولها MHC II قبل از اگزوسیتوز در غشای فاگولیزوزوم قرار میگیرد و ادغام این وزیکولها با غشای پلاسمایی آنتیژن را در دسترس سلولهای T و B قرار میدهد. در نهایت ماکروفاژها وارد رگ لنفاوی میشوند.
پروتئین های مکمل دفاع غیر اختصاصی کدامند ؟
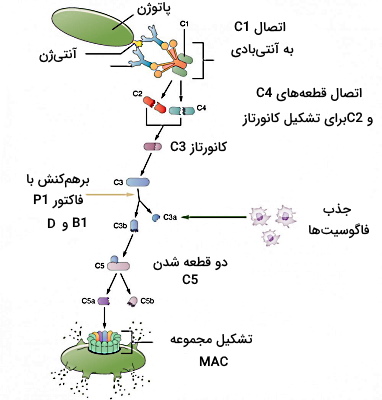
کبد اندام اختصاصی است که ژن کدکننده پروتئینهای مکمل در DNA آن وجود دارد. رونویسی و ترجمه این ژن نیاز به حضور پاتوژنها ندارد و پاتوژن پروتئینهای از قبل ترشح شده در خون را فعال میکند. این پروتئینها فاگوسیتوز پاتوژن بهوسیله ماکروفاژها را تسهیل میکنند. پروتئینهای مکمل از سه مکانیسم مختلف در دفاع غیر اختصاصی بدن شرکت میکنند.
- «مسیر کلاسیک» (Classic Pathway): در این مسیر پروتئینهای مکمل به آنتیبادیهای خاطره متصل به آنتیژن (ایمونوگلوبین G یا M) برهمکنش میدهند. شروع این مسیر به یک IgM (مولکول پنتامر) و ۶ IgG نیاز دارد. در این مسیر پروتئین مکمل C۱ اولین پروتئینی است که به بخش FC آنتیبادی متصل میشود.
به ترتیب به پروتئین مکمل C۱ متصل میشوند.
- افزایش نفوذ پذیری غشای میکرواورگانیسم: پروتئینهای مکمل
-
- یک کانال پنتامر (مجموعه حمله به غشا | Membrane Attacks’ Complex) تشکیل میدهند. این کانال در غشای پلاسمایی میکرواورگانیسم قرار میگیرد و نفوذپذیری سلول به آب و الکترولیتها را افزایش میدهد. در نتیجه باکتری تجزیه یا «لیز» (Lysis) میشود.
- «اوپسونیزیشن» (Opsonization): C۳b مولکول اوپسونینی است که با جدا شدن کانال پنتامر در دسترس گیرندههای C۳b در غشای سلولی ماکروفاژ قرار میگیرد. اتصال لیگاند-گیرنده در این سلولها فاگوسیتوز پاتوژن را تحریک میکند.
- تحریک مسیر التهابی: پروتئازهای ترشح شده از ماستسلهای فعال، با جدا کردن بخشی از توالی آمینواسیدی از پروتئینهای مکمل C۳a و C۵a این مولکولها را به سیتوکینهای فعال مسیر التهابی تبدیل میکنند.
- «مسیر جایگزین» (Alternative Pathway): در این مسیر پروتئین مکمل C۳b مستقیم به آنتیژنهای سطح سلول میکرواورگانیسم متصل میشود. در ادامه اتصال پروتئینهای مکمل
- با مکانیسمهای MAC، اپسونیزاسیون و تحریک مسیر التهابی به دفاع غیراختصاصی بدن کمک میکند.
- «مسیر لکتین» (Lectin Pathway): در این مسیر لکتین متصل شونده به مانوز به مولکولهای مانوز غشای پلاسمایی میکرواورگانیسمها متصل میشود. پس از اتصال پروتئین مکمل C۴ به لکتین، پروتئینهای
- به ترتیب کنار هم قرار میگیرند و میکرواورگانیسم با سه مکانیسم MAC، اپسونیزاسیون و تحریک مسیر التهابی از بین میرود.
اینترفرون های دفاع غیر اختصاصی
اینترفرونها مولکولهایی شیمیایی سیستم دفاع غیراختصاصی بدن هستند که به پاتوژنهای ویروسی پاسخ میدهند. ویروس ممکن است یکی از سلولهای سالم بدن یا ماکروفاژهای را آلوده کند. در این فاکتور رونویسی IRF بیان ژنهای اینترفرون آلفا و بتا در سلولهای بافت آلوده و اینترفرون گاما در لنفوسیتها را شروع میکند. اتصال اینترفرون-گیرنده در سلولهای سالم رونویسی ژن پروتئین کیناز R را را تحریک میکند. پروتئین کیناز R با فسفوریلاسیون پروتئینهای ویروسی از ورود این میکرواورگانیسم به سلول سالم جلوگیری میکند.
با فعال شدن فاکتورهای رونویسی در ماکروفاژ آلوده به ویروس، اینترفرونهای آلفا، بتا و گاما سنتز میشوند. اینترفرون آلفا و بتا پیام آلودگی ویروسی را به سلولهای سالم منتقل میکنند. اتصال این دو اینترفرون به گیرنده غشایی NKC (سلولهای کشنده طبیعی) سبب فعال شدن سلول میشود. NKC فعال شده مسیر آپوپتوز در سلولهای آلوده به ویروس را فعال میکند.
اتصال اینترفرون گاما به گیرنده سطح سلولی ماکروفاژهای سالم، رونویسی و بیان پروتئینهای مسیر تقسیم میتوزی و افزایش تعداد ماکروفاژها را تحریک میکند. به علاوه تعداد مولکولهای MHC I و MHC II در غشا افزایش مییابد.
پاسخ دمایی دفاع غیر اختصاصی
تب یا «پیرکسیا» (Pyrexia) به شرایطی گفته میشود که دمای بدن در پاسخ به عفونت یا بیماری افزایش مییابد. دمای بدن در شرایط فیزیولوژیک بین ۳۶٫۵ تا ۳۷٫۵ درجهسانتیگراد متغیر است. عوامل تبزا یا «پیروژنیک» (Pyrogenic) منجر به افزایش دمای بدن خارج از این دامنه میشوند و افزایش دمای بیش از ۴۰ درجهسانتیگراد عفونت شدید بدن ار نشان میدهد. مرکز اصلی تنظیم دمای بدن هیپوتلاموس و مولکول شیمیایی آن پروستوگلاندین ۲ (PGE۲) است. PGE۲، ترومبوکسان و لوکوترین از محصولات مسیر آراشیدونیکاسید هستند که بهوسیله فاکتورهای التهابی (سیتوکینهای آزاد شده از ماکروفاژ یا بافت آسیبدیده) فعال میشود.
در این مسیر فسفولیپدهای غشای آسیبدیده یا سیتوپلاسم ماکروفاژ، بهوسیله فسفولیپاز۲ (لیپاز متصل به غشا | PLA۲)، سیکلواوکسیژناز (COX-۲) و پروستوگلاندین سنتتاز ۲ به PGE2 تبدیل میشود. آسپیرین و داروهای غیراستروئیدی ضدالتهاب (NSAIDs) با مهار آنزیم COX-۲ مسیر التهاب را سرکوب میکنند. به علاوه اتصال IL-۱، IL-6 و TNF (پیروژنها) ترشح شده از ماکروفاژها و سلولهای دندریتی فعال، به گیرندههای نورونهای هسته پریاپتیک در هیپوتالاموس، سنتز COX-۲ را افزایش میدهد.
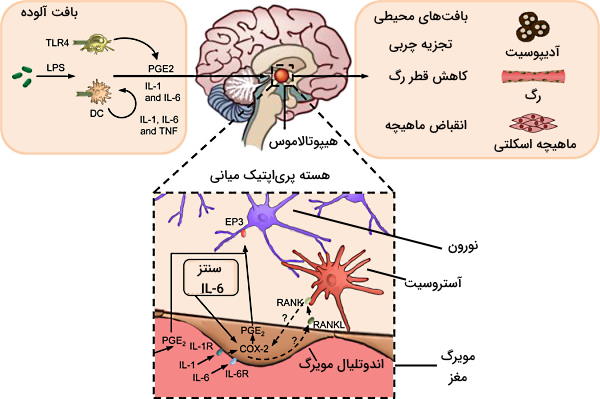
اتصال PGE۲ به گیرندههای نورونهای سمپاتیک با تحریک متابولیسم چربیها در بافت چربی، به افزایش دمای بدن کمک میکند. به علاوه تحریک ماهیچههای صاف دیواره رگ بهوسیله این اعصاب، از دست دادن انرژی گرمایی بدن را کاهش میدهد. در این شرایط اعصاب کولینرژیک با آزادسازی استیلکولین انقباض ماهیچههای اسکلتی و لرزش بدن را تحریک میکنند.
یکی دیگر از پیوژنهایی است که اتصال آن به گیرنده آستروسیتها با افزایش سنتز COX-۲ سنتز PGE۲ و شروع تب را افزایش میدهد.
تب یکی از مکانیسمهای سیستم ایمنی ذاتی برای دفاع از بدن در برابر پاتوژنها است. در این مکانیسم افزایش دما با دناتوره کردن پروتئینهای ساختاری و عملکردی از رشد میکرواورگانیسم جلوگیری میکند. اما اگر افزایش دمای بسیار زیاد باشد، علاوه بر پاتوژنها پروتئینهای طبیعی بدن را دناتوره میکند.
پاسخ سیستم ایمنی به تب
افزایش دمای بدن در تب با تغییر عملکرد نوتروفیلها، سلولهای کشنده طبیعی، ماکروفاژ و سلولهای دندریتی، کارایی دفاع غیر اختصاصی بدن را افزایش میدهد.
- نوتروفیل: افزایش دمای بدن با افزایش ترشح فاکتور کولونی گرانولوسیت (G-CSF) رهایش نوتروفیلها از مغز استخوان را افزایش میدهد. افزایش دما با اثر بر فاکتور شوک گرمایی ۱ (HSF۱) رونویسی CXCL۸ را افزایش میدهد. افزایش CXCL۸ در خون، کموتاکسی نوتروفیلها به ریه را فعال میکند.
- سلولهای کشنده طبیعی: افزایش دمای بدن با افزایش سنتز چاپرون HSP۷۰ در سلولهای توموری، بیان MHC I در این سلولها را کاهش و اثر NKC را افزایش میدهد.
- ماکروفاژ و سلولهای دندریتی: افزایش دمای بدن با افزایش سنتز و فعالسازی HSP70 در ماکروفاژها، فعالیت فاگوسیتوزی ماکروفاز و رهایش سیتوکینهای نیتریکاکسید (NO)، IL-۶، IL-۱b و IL-۱۲ را افزایش میدهد. به علاوه افزایش دما با افزایش بیان گیرندههای TLR۲ و TLR۴ در سلولهای دندریتی همراه است.
ارتباط دفاع غیر اختصای و اختصاصی
بدن انسان علاوه بر سیستنم دفاع غیر اختصاصی از مکانیسمهای دفاع اختصاصی (لنفوسیتهای T و B) برای از بین بردن میکرواورگانیسمها استفاده میکند. تفاوت اصلی این سیستم ایمنی اختصاصی بودن نوع پاسخ به نوع آنتیژن ورودی است. سلولهای ارائهدهنده آنتیژن، سلولهای ایمنی هستند که بین این دو سیستم دفاعی بدن ارتباط برقرار میکنند.
ماستسل، ائوزینوفیل و باوزفیل، ماکروفاژ و سلولهای دندریتی لنفوسیت B فعال APCهای سیستم ایمنی بدن هستند. برای توضیح بهتر فعالیت این سلولها، ماکروفاژ را در نظر بگیرید. در بخشهای قبلی توضیح دادیم که آنتیژن سلول فاگوسیتوز شده در لیزوزیم ماکروفاژ بهوسیله گیرندههای MHC II در سطح این سلول قرار میگیرد و سلول از مایع میانبافتی به سیستم لنفاوی مهاجرت میکند. در سیتستم لنفاوی ماکروفاژها به گیرندههای TRC (اتصال آنتیژن) و CD۴ (اتصال به MHC II) در سطح لنفوسیتهای کمککننده (Th) متصل میشوند. TCRs گیرندههای اختصاصی هستند که برای آنتیژنهای اختصاصی بیان شدهاند. برهمکنش این دو سلول با سه محرک متفاوت مسیرهای سنتز و ترشح IL-۲ از لنفوسیت T فعال میکند.
- اتصال MHC II و CD۴، پروتئین تنظیمی درون سیتوپلاسمی CD۳ را فعال میکند (سیگنال اولیه).
- اتصال CD۲۸ به پروتئین B۷، اثر داخل سلولی گیرندههای قبلی را افزایش میدهد (محرک کمکی).
- IL-۱ ترشح شده از ماکروفاژ به گیرنده لنفوسیت T متصل میشود.
آنتیژن محلول در لنف، به طور اتفاقی با لنفوسیتهای B ساده برخورد میکند و بر اساس رابطه مکملی با آنتیبادیهای D سطح این سلولها با اندوسیتوز وابسته به گیرنده وارد این سلولها میشود. اتصال آنتیژن-آنتیبادی در این سلولها رونویسی و بیان گیرندههای MHC II در کروموزوم ۶ سلولهای B را فعال میکند. در ادامه گیرنده MHC II به همراه آنتیژن خارجی به غشای منتقل و لنفوسیت فعال خواهد شد.
تمام این محرکها با فعال کردن لنفوسیت T، سنتز و ترشح اینترلوکین ۲ را تحریک میکنند. IL-۲ با اتصال به گیرندههای سطح لنفوسیت (اثر اتوکرین) سنتز IL-۴ و IL-۵ را تحریک میکند. اتصال IL-۴ به گیرنده سبب تشکیل Th۲ میشود. IL-۴ به لنفوسیت B فعال شده متصل و تقسیم میتوزی این سلولها فعال میشود. تفاووت این سلولها با لنفوسیتهای b قبلی در نوع گیرنده سطحی آنها است. آنتیبادی سطحی لنفوسیت B فعال برای یک نوع آنتیژن (آنتیژن اتصالی به سلول B ساده) خاص اثر دارد. اثر IL-۵ بر سلولهای B فعال سبب تمایز این سلولها به «سلولهای پلاسما» (Plasma Cell) و سلول B خاطره میشود. در ادامه اتصال IL-۶ و IL-۵ ترشح شده از Th۲ به گیرندههای پلاسماسلها سنتز و ترشح آنتیبادیهای اختصاصی آنتیژن را تحریک میکند. آنتیبادیهای محلول در خون با خنثی کردن اثر باکتری (اتصال به آنتیژنهای سطحی)، رسوب آنتیژنهای محلول، کمک به پروتئینهای مکمل (C۱ به آنتیبادی-گیرنده متصل میشود)، انعقاد گلبولهای قرمز غیرخودی در فرایند انتقال خون و اوپسوزیناسیون (آمادهسازی آنتیژن برای فاگوسیتها) شرکت میکنند.
اختلال سیستم دفاعی غیر اختصاصی
نقص عملکرد سیستم ایمنی ذاتی زمانی ایجاد میشود که سلولهای ایمنی این بخش به دلیل نقص در گیرندههای سلولی یا اختلال تکثیر و تمایز سلولهای بنیادی خونساز قادر به حذف کامل پاتوژنها نیستند. این اختلالها ممکن است بر اثر جهشهای ژنتیکی ایجاد شود یا اثر جانبی بیماریهای دیگر باشد. نقص گیرندههای TLR، سلولهای NK، نقص پیامرسانی
و
سه اختلال اصلی سیستم دفاع غیراختصاصی هستند. به علاوه انواع تومورهای مغز استخوان با افزایش تعداد سلولهای ایمنی، همئوستازی بدن را مختل میکند.
نقص گیرندههای TLR
MyD۸۸ (پروتئین پاسخ اولیه به تمایز میلوئید ۸۸| Myeloid Differentiation Primary Response Protein ۸۸) پروتئین پیام تمام TLRها به جز TLR۳ است. نقص این پروتئین برای اولین بار در کودکان مبتلا به عفونتهای مکرر باکتریایی شناخته شد. حساسیت این کودکان به باکتریهای سالمونلا نومونیا، سالمونلا اورئوی و نومونیا پیروژنوزا زیاد بسیار زیاد بود. اما نسبت به عفونتهای ویروسی، قارچی، انگلها و سایر باکتریها مقاومت طبیعی داشتند. حساسیت به عفونت در این بیماران با افزایش سن کاهش یافت که نشان میدهد سیستم ایمنی پروتئین دیگری را جایگزین MyD۸۸ کرده است. جهش ژنهای اتوزومی عامل ایجاد این نقص ایمنی است. IRAK۴ یکی دیگر از پروتئینهای پیامرسان این سیستم است که علائمی مشابه نقص MyD۸۸ ایجاد میکند.
UNC۹۳B۱ یکی از پروتئینهای مسیر سیگنالینگ سنتز اینترفرونها است. نقص در این پروتئین یا TLR۳ (گیرنده اتصالی به RNA ویروسی) احتمال ابتلا به آماس مغز در عفونت ویروس هرپس سیمپلکس (Herpes Simplex | HSV-۱) را افزایش میدهد.
نقص سلولهای کشنده طبیعی
سلولهای کشنده طبیعی بدون مشارکت سلولهای T کشنده و با بههم ریختن غشای سیتوپلاسمی سلول آلوده به ویروس یا توموری در سیستم دفاع غیر اختصاصی شرکت میکنند. جهش ژنتیکی کروکوزومهای اتوزومی عامل کاهش تعداد این سلولها یا ناکارامدی آنها در حذف سلولها است.
نقص مسیر سیگنالیگ اینترفرون گاما و اینترلوکین ۲
اینترفرون گاما و IL-۲ سیتوکینهای مهم بدن در دفاع غیر اختصاصی در مقابل باکتریها به خصوص باکتری توبرکولوزیس هستند. نقص در ساختار این پروتئینها یا هر یک اجزای مسیر انتقال پیام آنها، حساسیت بدن به عفونتهای مایکوباکتریوم و سالمونلا را افزایش میدهد.
سوالات متدوال
در این بخش به تعدادی از سوالات متدوال پیرامون دفاع غیر اختصاصی بدن پاسخ میدهیم.
تفاوت مولکولهای MHC I و MHC II چیست ؟
مجموعه اصلی سازگاری بافت (Major Histocompatibility Complex | MHC) از دو دسته مولکولهای MHC I و MHC II تشکیل میشود. این پروتئینها، رسپتور غشایی هستند که آنتیژنهای خودی و پاتوژن را شناسایی میکنند. MHC I گیرندهای عرض غشایی با یک دومین ۸ تا ۱۰ آمینواسیدی برای شناسایی لنفوسیتهای T (با مولکول
) است. ژن این گیرنده تقریبا در تمام سلولهای هستهدار بدن انسان قرار دارد اما آللهای آن در افراد مختلف متفاوت است. به همین دلیل در پیوند عضو شباهت این مولکولها بسیار مهم است. ژن این گیرنده در پاسخ به آنتیژنهای داخلی فعال میشود.
MHC II رسپتوری با یک توالی ۱۳ تا ۱۸ آمینواسیدی برای شناسایی لنفوسیت است که آنتیژنهای غیرخودی را پس از فاگوسیتوز در سطح سلولهای دندریتی و ماکروفاژها قرار میدهند تا شناسایی آنها بهوسیله سلولهای T (با مولکول
) راحتتر انجام شود. ژن این گیرنده در پاسخ به پاتوژنها فعال میشود.
جمع بندی
در این مطلب توضیح دادیم که سیستم ایمنی غیر اختصاصی یا ذاتی بدن انسان از سلولها و مواد شیمیایی تشکیل میشود که پاسخهای یکسانی برای پاتوژنهای مختلف دارند. پوست اولین سد دفاعی بدن در برابر بسیاری از پاتوژنها است. لایه مخاطی، آنزیم لیزوزوم ترشحات بدن، pH اسیدی براق و ترشحات لولههای ادراری عواملی دیگری هستند که از ورود پاتوژنها به بدن جلوگیری میکنند. اگر پاتوژن از سد این بخش از دفاع غیر اختصاصی عبور کند، سلولهای ایمنی آن را شناسایی و بهوسیله التهاب یا پروتئینهای مکمل از بین میبرند. به علاوه ماکروفاژها و سلولهای دندریتی، سلولهای ایمنی هستند که با راائه آنتیژن به لنفوسیتها بین دفاع غیر اختصاصی (ذاتی) و اختصاصی (اکتسابی) ارتباط برقرار میکنند.